
Contents
화학평형의 개념
평형상수
1. 화학평형의 개념
가역 반응에서 화학적 평형을 관찰할 수 있다. 평형 상태는 어떤 가역 반응이 시간이 충분히 흐른 후에 더 이상 알짜 농도 변화를 관찰할 수 없는 상태를 의미한다. 그렇다고 반응이 전혀 발생하지 않음을 뜻하지 않는다. 평형 상태에 놓인 계를 분자적 관점에서 살펴보면 정반응과 역반응이 모두 발생하는 중이다. 다만 정반응에 대한 반응 속도와 역반응에 대한 반응 속도가 동일하기 때문에 거시적으로 관찰했을 때 변화를 파악하기 힘든 것이다.
2. 평형상수
① 평형상수의 개념
정반응과 역반응을 모두 단일 단계 반응으로 갖는 일반적인 반응을 살펴보자. 다음은 반응식과 정반응과 역반응의 반응 속도를 초기에 넣어준 물질에 대하여 표현한 것이다.

이 반응이 평형상태에 놓여있다면 양방향으로의 반응속도가 동일하므로, 아래와 같이 식을 정리할 수 있다.
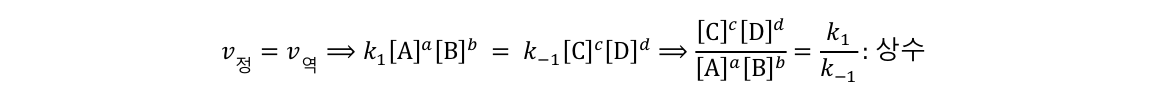
즉, 평형 상태에서 농도 사이의 특정한 비율은 일정한 값을 가지며, 이 값을 평형 상수라고 한다. 평형상수는 2가지 변수에 의하여 수치가 결정된다. 평형상수는 반응이 발생하는 온도에 의존한다. 계의 온도가 변하면 반응하는 정도가 변할 수 있기 때문이다. 평형상수는 또한 반응에 대해 의존한다. 가역 반응이 단일 단계 반응이라고 가정하면 반응의 계수에도 의존할 수 있으며 정반응과 가역 반응의 정도, 평형 상태시의 각 물질의 농도 등 반응의 정보에 의하여 평형 상수 값이 변할 수 있다.
② 기체의 압력으로 표현한 평형 상수 $K_p$
만약 반응물과 생성물이 기체를 포함할 경우에는 몰농도 대신 부분 압력을 사용해서도 평형 상수식을 표현할 수 있다.

몰농도를 사용한 평형상수와 구분하기 위해서 $K_p$로 표기한다. 이상 기체 상태 방정식을 이용하면 압력에 대한 식을 온도와 반응에 대한 몰 변화$\delta n$를 이용해서 표현할 수 있다.


이때 $\delta n = (c+d)-(a+b)$라고 하고 몰 농도를 이용한 평형상수를 대입하면 식을 얻을 수 있다.

실제 수치를 계산할 때 이상 기체 상태방정식의 단위를 따라 를 이용하며 온도는 절대 온도를 사용한다.
③ 활동도와 평형상수의 엄밀한 논의
활동도는 이상적인 혼합물 속에서 표준 농도 1M에 대한 해당 물질의 농도 비이거나, 표준 압력 1atm에 대한 해당 물질의 압력의 비이다. 만약 어떤 물질이 0.01M이라면 활동도는 1M에 대한 비 값인 0.01M/1M=0.01로 표현할 수 있다. 하지만 실제 농도와 활동도가 비슷한 경우는 묽은 용액만 해당한다. 진한 용액의 활동도는 용질 사이의 상호작용으로 녹아 있는 용질의 몰수와 다른 값을 보이며 몰 농도와 활동도가 차이가 날 수 있다. 한편, 고체나 액체는 주어진 물질에 대하여 행동하는 경향성이 거의 비슷하기 때문에 활동도가 1로 표현된다.
활동도를 이용하면 농도나 압력을 사용할 때 보다 평형상수를 정확하게 표현할 수 있다. 활동도를 사용하지 않으면 반응식의 계수에 대해 $a+b=c+d$인 경우를 제외하면 단위가 남는다. 그러나 활동도는 단위가 없기 때문에 구한 값을 대입하여 단위 없는 평형상수를 얻을 수 있다. 또한 평형 상수를 구할 때 액체와 고체를 무시하는 이유도 쉽게 알 수 있다. 반응물과 생성물에 있는 모든 물질의 활동도를 평형 상수를 구할 때 사용하더라도 결국 고체 및 기체의 활동도는 1이기 때문에 무시한 것과 같은 결과값을 얻을 수 있다.
④ 반응지수$Q$와 평형 상수의 비교를 통한 반응의 방향성 파악
두 변수에 의해 결정된 평형 상수의 크기로 반응의 경향성을 알 수 있다. 만약 평형 상수 값이 작다면 생성물의 양이 적은 것을 의미하며 역반응이 활발한 것을 의미한다. 반대로 평형 상수 값이 크다면 생성물의 양이 많으며, 정반응이 활발함을 뜻한다. 그리고 평형 상수의 값이 적당히 중간값을 갖는다면 반응물과 생성물이 비슷한 정도로 남아있음을 뜻한다. 화학 공정 등에서는 평형 상수가 매우 작거나 매우 큰 반응을 선호하며, 이는 얻고자 하는 물질을 더 많이 얻을 수 있기 때문이다.
위의 방법은 평형 상수의 크기만을 이용해서 반응이 전반적으로 어떤 상태에서 평형이 형성되는 지를 알 수 있다. 여기에 반응 지수 를 이용하면 현재 상태에서 반응이 어떻게 진행될 것인지도 알 수 있다. 반응 지수는 평형 상수와 값을 구하는 방법이 동일하지만, 대입하는 값이 평형 상태의 활동도가 아니라 특정 시점에서의 활동도를 대입하면 구할 수 있다. 반응 지수와 평형 상수의 비교는 아래의 세가지 경우로 비교할 수 있다.
ⅰ) $Q<K$인 경우에는 생성물의 농도가 작은 경우다. 평형에 도달하기 위하여 생성물이 더 많이 생성되어야 하므로 반응이 왼쪽에서 오른쪽으로 진행되는 정반응이 우세하다.
ⅱ) $Q=K$인 경우에는 평형 상태에 도달함을 뜻한다.
ⅲ) $Q>K$인 경우에는 생성물의 농도가 큰 경우다. 평형에 도달하기 위하여 생성물이 감소해야 하므로 반응이 오른쪽에서 왼쪽으로 진행되는 역반응이 우세하다.
⑤ 다양한 반응에 대한 평형 상수의 결정
역반응, 동일 반응의 반복(계수의 변화), 반응 메커니즘에서의 평형 상수도 구할 수 있다.
ⅰ) 역반응에서의 평형 상수
평형 상수는 (생성물)/(반응물)꼴로 표현된다. 역반응은 반응물과 생성물의 위치가 바뀌는 것이므로 역반응의 평형 상수는 기존의 반응을 기준으로 (반응물)/(생성물)꼴로 표현된다. 따라서 역반응의 평형 상수는 정반응의 평형 상수에 대해 역수 값을 갖는다.

ⅱ) 계수의 변화와 평형 상수
어떤 반응식의 계수가 배 변했다면 그 반응의 평형 상수는 기존의 평형상수의 제곱을 한 값을 갖는다.

이는 반응의 평형 상태에 존재하는 물질들의 농도는 반응 계수와는 무관하지만, 평형 상수는 계수의 변화로 값이 변할 수 있음을 뜻한다.
ⅲ) 반응 메커니즘의 평형 상수
반응 메커니즘의 평형 상수는 각 단일 단계의 평형 상수를 곱한 값과 같다.

'전공 개념.zip > 일반화학' 카테고리의 다른 글
| 화학평형의 이동 - 르 샤틀리에의 원리 (0) | 2022.04.05 |
|---|