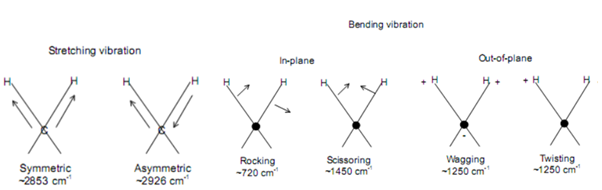
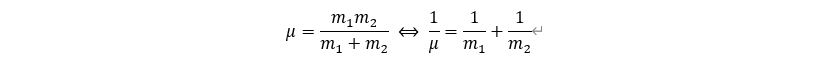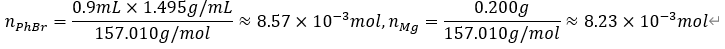Ⅰ. Title
입도분석 (Particle Analysis)
Ⅱ. Purpose
이 실험을 통해서 입자(particle)의 제타포텐셜과 입자의 크기(size)를 구한다. 또한 sample의 pH가 변화함에 따라 이 용액속에 분산되어 있는 입자의 제타포텐셜과 입자의 크기가 크기를 구해본 후 변화 정도를 계산하여 각 요소 사이의 관계를 이해한다.
Ⅲ. Theory
1. pH와 등전점
1) pH
pH는 용액이 어느 정도의 산도를 갖고 있는지를 보여주는 지표이며, 용액 속의 수소이온 농도 [H+]를 이용해서 측정한다.
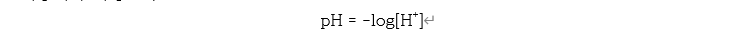
2) 등전점(isoelectric point, pI)
양쪽성 이온과 같은 물질처럼 어떤 물질들은 전하량의 분포가 다양하다. 일정 조건 하에서 물질의 알짜 전하량이 0이 되는데, 이 지점을 등전점이라고 한다. 대표적으로 등전점을 가지는 물질은 이양성자산이다. 이양성자산의 등전점은 1차 pKa와 2차 pKa의 평균값이다.
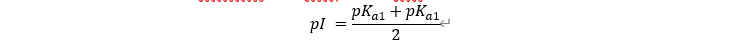
산 해리 상수 pKa는 알려져 있는 경우도 있지만, Henderson-Hasselbalch equation (HH equation)을 이용하면 미지의 물질을 사용하더라도 측정한 pH와 산과 짝염기 사이의 농도비를 이용해서 측정을 할 수 있다.

2. 콜로이드와 제타포텐셜
1) 콜로이드(colloid)
용질의 형태가 비교적 커서 용매에 입자들이 분산된 형태가 관찰될 수 있는데, 이처럼 어느 정도 이상의 크기를 갖고 있는 입자를 콜로이드라고 한다. 콜로이드의 표면적은 비교적 크기에 이를 구성하는 작용기의 이온화 또는 용매의 입자의 흡착 등으로 정전기적 전하를 가질 수 있게 된다. 즉 콜로이드 입자가 (+)전하 또는 (-)전하로 대전이 되어있으며 그 주위를 반대 전하를 갖는 물질(이온)이 둘러싸서 열운동(e.g. 브라운 운동)을 할 수 있게 된다.
2) 제타 포텐셜(Zeta potential)
콜로이드가 전하를 띠게 된다면 이온 흡착 등을 따라서 이온들이 콜로이드 주변에 흡착될 수 있다. 다만 단순히 하나의 층을 이루는 것이 아닌, 전기 이중층(Electric Double Layer)을 형성한다. 콜로이드 표면에 인접한 외부에는 Stern Layer가 형성되고, 이는 잘 움직이지 않는다. Stern Layer의 밖에는 Diffused Layer가 형성되며, 이온들과 극성 액체 분자들이 steady-state configuration을 가지며 상대적으로 활발히 움직인다. 각 Layer의 표면마다 surface potential을 결정할 수 있는데, Diffusion Layer의 surface인 slipping plane의 potential을 제타 포텐셜(zeta potential)이라고 한다. 콜로이드가 갖고 있는 전하에 따라서 형성되는 EDL과 그에 따른 Zeta Potential의 약간의 차이가 있는데, 그림 1에는 콜로이드의 surface charge가 negative인 경우를 나타낸 것이다.

제타 포텐셜은 콜로이드의 Stability를 나타낸다. 제타 포텐셜의 절댓값 이 높으면 그만큼 콜로이드는 더 잘 분산된다. 그렇지 않은 경우 콜로이드가 응집할 수 있으며, 제타포텐셜의 범위와 그에 따른 콜로이드의 안정성을 그림 2로 나타냈다.

3. DLVO theory
콜로이드는 DLE를 형성하고 있기에 여러가지 상호작용이 나타날 수 있다. 이 시스템에서는 Van Der Waals 상호작용, EDL에서의 Repulsion과 Attraction, 그리고 다른 입자들 사이에서 관찰되는 Born Interaction이 있다. 해당 상호작용을 모두 더해서 관찰되는 알짜 potential을 얻을 수 있으며, 이 potential을 기준으로 콜로이드의 Stability를 나타내는 것을 DLVO theory라고 한다.
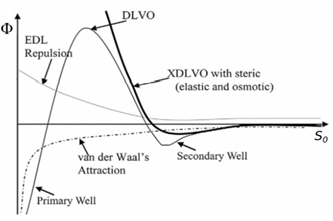
물질들은 최대한 안정한 에너지를 유지하려 하며, 그림 3의 DLVO model에서도 낮은 에너지 준위를 유지하려 한다. 입자들의 사이가 어느 정도 가깝다면, 아예 그 거리를 최소화해서 (i.e. 응집(coagulation)과 응결(flocculation) 진행) 안정성을 유지하려 한다. (Primary Well) 이에 반해 입자들 사이의 거리가 어느정도 멀다면 입자들 사이의 거리를 어느 정도 유지해서 시스템의 안정성을 유지하려 한다. (Second Well)
4. 동적 광 산란법 (DLS Method)
콜로이드의 물성은 보통 nanoparticle analyzer을 이용해서 측정한다. 기기는 각각의 방식을 따라 물성을 측정하지만, 동적 광 산란법 (Dynamic Light Scattering, 이하 DLS)은 많이 사용되는 방법이고 이번에 실험에서 사용되는 SZ-100도 이 기법을 이용해서 콜로이드를 관찰한다.

5. Stokes Einstein: 입자의 거동성과 입자 움직임 사이의 관계
solution에서 작은 입자(용질, 콜로이드 등)은 무질서한 움직임을 보이고, 이를 브라운 운동이라고 한다. 물질의 물리적 거동성을 이용하면 입자의 크기를 정할 수 있는데, 그 중에서 브라운 운동과 입자의 크기 사이의 관계를 보이는 식이 Stokes Einstein Equation이다.

Ⅳ. Chemicals & Apparatus
1. Chemicals
증류수, 6N HCl 용액, 6N NaOH, 1mL 10% bead solution, pH Standard solution (4.01, 10.00), Titanium Dioxide Solution, sample base
2. Apparatus
pH meter, 100mL 비커, magnetic stir bar, stirrer, micro pippet, pippet tip, nano particle analyzer(SZ-100), electrode cuvette, open disposable cuvette
Ⅴ. Procedure
1. pH meter를 이용한 pH 조정
1) 비커에 0.14g의 TiO2 Solution을 정량한 후 50mL 증류수를 담은 후, magnetic bar를 비커에 넣고 5분 정도 stirring을 진행한다. (sample base)
2) pH standard solution을 이용해서 pH meter기의 Calibration을 진행한다.
3) pH meter기를 이용해서 stirring을 하고 잇는 sample base의 pH를 측정한다.
4) NaOH나 HCl을 추가하면서 적절히 pH를 조정한다. (이번 실험에서는 pH 2.01, 3.38, 8.76, 9.99)
2. Zeta Potential 측정
1) electrode cuvette에 정량한 시약을 200μL를 넣는다.
2) 기기를 다음과 같이 Setting한다.
- Measurement duration = 80 ~ 120s, Standard Calculation, Measurement time = 3~5 min
3) SZ-100에 샘플을 넣은 후 기기를 작동시켜서 Zeta potential을 측정한다.
3. Particle Size 측정
1) 4 open disposable cuvette에 정량한 시약 1mL를 넣는다.
2) 기기를 다음과 같이 Setting한다.
- Measurement duration = 80 ~ 120s, Standard Calculation_advance_volume, Measurement time = 3~5 min
3) SZ-100에 샘플을 넣은 후 기기를 작동시켜서 Particle Size를 측정한다.
Ⅵ. Data & Result
|
pH |
Zeta Potential 1 (mV) |
Zeta Potential 2 (mV) |
mean Zeta Potential (mV) |
|
2.04 |
1.5 |
0.6 |
1.05 |
|
3.38 |
-0.2 |
0.1 |
-0.05 |
|
8.76 |
-0.5 |
-0.5 |
-0.5 |
|
9.99 |
-2.5 |
0.1 |
-1.2 |

|
pH |
size 1 (nm) |
size 2 (nm) |
mean size (nm) |
Z-avg (nm) |
|
2.04 |
1850.1 |
1824.3 |
1837.2 |
- |
|
3.38 |
134.1 |
132.3 |
133.2 |
131.5 |
|
8.76 |
136.9 |
137.2 |
137.05 |
134.6 |
|
9.99 |
131.9 |
133.5 |
132.7 |
134.4 |

Ⅶ. Discuss
1. Colloid Particle Surface (Charge) 조정
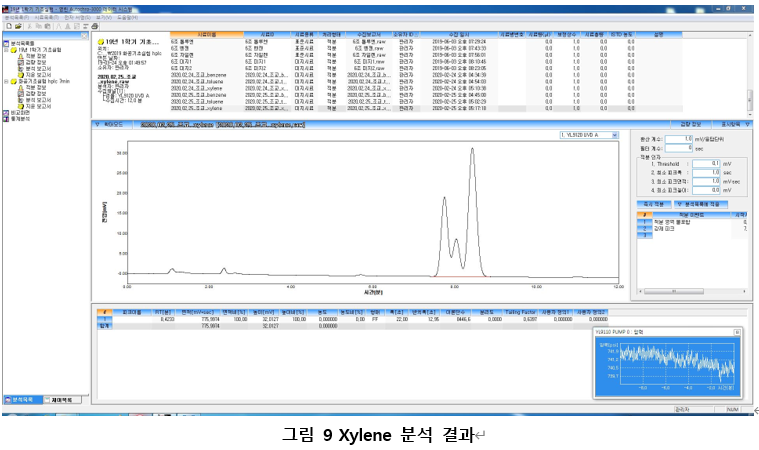
이번 실험에서 사용하는 물질은 TiO2이다. 이 물질은 놓여있는 pH 조건 하에서 표면의 전하가 바뀌고, 이는 Zeta potential을 결정한다. 알짜전하가 0인 등전지점을 기준으로 상대적으로 수소이온의 농도의 차이에 따라 TiO2 표면의 전하가 어떻게 변하는 지를 아래의 그림 9에 표현했다.
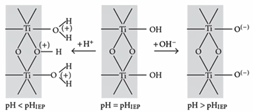
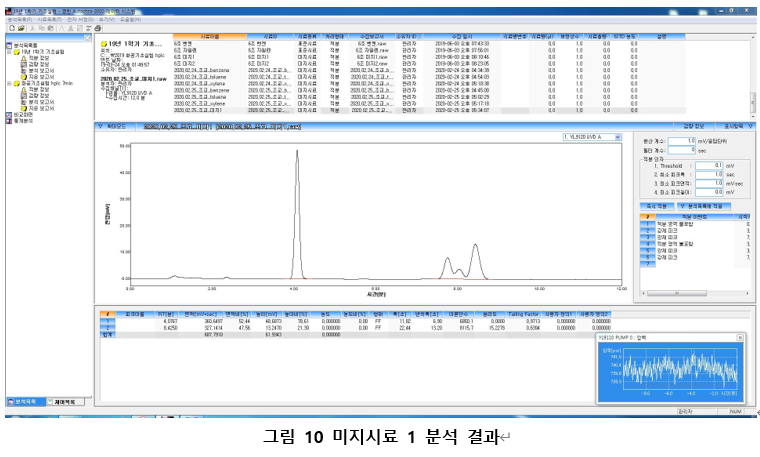
즉 acidic solution에서부터 TiO2의 Surface charge를 측정하면 (+) -> 0(pI) -> (-)로 변한다. (TiO2의 pI는 6.9정도로 알려져 있다.) 우리가 측정하게 되는 입자는 DLE를 포함한 가상의 입자이지만, 이때에도 surface의 charge는 순수 콜로이드 입자와 동일하며, Zeta potential도 (+) -> 0(pI) -> (-)로 변화한다. 실제로 측정 결과를 보면 아래의 그림 10의 Zeta potential을 보이며 측정하는 TiO2의 phase에 따라 다르게 관찰되는 것 또한 알 수 있다.

2. Zeta Potential 측정 원리
nano particle analyzer(이하, SZ-100)가 property를 어떻게 측정하는 지를 살펴보자. 이상적인 pI에 위치하지 않은 입자들은 전하를 띠고 있기에 전압에 의해서 입자들이 움직이게 된다. (입자가 pI에 위치해 있더라도 TiO2 산소 등을 포함하고 있기에 외부에서 전압을 지속적으로 가하면 입자가 이동할 수 있다.) 여기서 입자의 이동 속도를 이용해서 표면의 전하를 측정하면 Zeta potential을 얻을 수 있으며, 이동에 의한 입자들의 dispersion 정도를 측정하면 입자의 크기를 알 수 있다. Zeta potential은 입자의 mobility를 이용해서 측정한다. mobility는 system에 작용하는 외력에 대한 입자의 이동속도의 비율을 이용해서 얻으며, 실험의 상황과 해당 식들을 아래에 표현했다. (전압을 가해서 입자를 움직이는 방식은 전기영동에서 나타나는 설명과, 해당 현상을 해석하는 방식과 유사하다.)

3. 입자 크기 측정 원리
Z-100은 초기의 입자 배치를 기준으로, 전압을 가하는 시간에 비례하여 입자들의 움직인 정도를 분산 정도로 생각하여 입자의 움직임 정도를 결정한다. 실험에서 사용한 기기로는 입자의 순수한 크기는 측정하기 힘들며, hydrodynamic diameter(Dh ), 즉 입자가 들어있는 media가 TiO2를 주위를 감싸고 있는 가상의 입자의 직경을 재는 것이다. 이는 Stoke-Einstein equation 통해 결정된다.
Dh=kBT3πηDt
이때 SZ-100은 Dynamic Light Scattering (이하, DLS) 기법을 이용해서 입자가 media에서 어떻게 거동을 보이고 있는 지를 결정하며, 이는 Translational diffusion coefficient(Dt )로 표현된다. SZ-100은 입자의 브라운 운동 정도를 파악하기 위해서 cuvette에 전압을 가한다. (이번 실험에서는 2V 정도의 전압을 이용했다.)

위의 그림에서 표현된 것처럼 측정하고자 하는 입자의 모든 크기들이 균일하지 않다. 그렇기에 해당 system에 빛을 쏘았을 때 각각의 입자에 대해서 scatter 정도를 측정하고, SZ-100이 이 정보들을 모아서 Autocorrelation Function(G2(τ), 이하 ACF)를 얻어내며, 해당 그래프와 식은 아래와 같다.

위의 식 중 q를 결정하는 변수는 refractive index of the liquid(굴절률, n), wavelength of the laser light(광원의 파장, λ), scattering angle(빛의 산란 각도, θ)가 있다. 이 식이 어떻게 Dt(위의 식에서는 Dm)이 결정되는지를 살펴보기 위해서 이번 실험에서 얻은 pH 8.76에서의 Data를 이용해보자.

ACF식과 실험 결과로 얻은 식을 비교하면 여러 계수들의 값을 결정할 수 있으나, 우리가 중요하게 여길 계수는 exp안에 들어있는 -0.004이다. 지수 안의 수는 무차원(dimensionless)을 유지해야 하므로 실제로는 -0.004/s인 것을 알 수 있다. 이를 이용해보자.

Dt의 차원은 L2/T이고, 오른쪽 항의 계산식의 차원 또한 T-1×(L/dimensionless)2=L2/T이다. 즉 죄/우 항의 차원이 같은 것을 알 수 있으므로, 식의 유도가 성립함을 알 수 있다. 다만 굴절률, 광원의 파장, 빛의 산란 각도는 Excel 파일에 따로 없었으며, 이들을 반영하여 Dt를 결정한 것으로 보인다. 이 값을 얻은 후 Stoke-Einstein equation에 대입하면 Dh를 얻을 수 있다. (이번 실험에서의 T는 25℃이며, viscosity η는 0.893 mPa∙s정도였다.)
4. 실험 결과 해석
이제 이번 실험에서 얻은 데이터들을 살펴보자.
1) Zeta potential
그림 7과 그림 10을 합쳐서 알려져 있는 Zeta potential과 이번 실험에서 실제 측정한 Zeta potential의 경향성을 비교해보자.

우선 TiO2 system의 pH가 증가할수록 입자의 전하가 (-)로 변하므로 Zeta potential도 (-)를 보여야 한다. 실험 결과 Zeta potential의 크기 차이는 적지만 확실히 양의 값에서 음의 값으로 감소하는 경향성을 보인다. 일반적으로 알려져 있는 pI = 6.9 정도로 Received dry TiO2에서 관찰할 수 있다. 하지만 직접 측정한 Data에서 pI는 3.5 ~ 4에서 형성이 된 것을 확인할 수 있다. 해당 수치는 Slurry 형태의 TiO2의 pI와 거의 유사한 수치이다. 그렇기에 실험에서 사용한 TiO2 콜로이드 입자들이 매우 인접한 거리에 있었다는 것을 생각할 수 있다. (예상하던 것 보다 고농도의 시료가 사용된 것처럼 측정이 됨) TiO2의 자체 침전성이 있기 때문에 이 이야기도 신빙성은 있다고 생각되나, Zeta potential 수치를 이용해서 설명해보자. 실험 결과 Zeta potential의 절댓값은 1.5보다 크지 않으며, 이 수치는 콜로이드가 매우 불안정한 상태를 뜻하며 콜로이드가 급격한 응결/응집을 일으킨다. 이는 DLVO graph에서 해당 콜로이드 system이 primary well으로 향하여 system의 안정성을 유지하려 하는 것이다. (그림 3 참조) 이 설명들을 통해서 우리가 측정한 system 내의 콜로이드들의 입자 사이의 거리가 매우 가까이 유지되어 slurry 형태를 유지함을 알 수 있다. 다만 콜로이드가 slurry가 될 때 입자가 ‘어떻게’ Slurry 상태로 도달하는 지에 대해 생각을 해봐야 하는데, 이는 입자의 particle size를 관측한 Data를 확인 후 설명하겠다.
2) particle size
TiO2 colloid에 대해 알려져 있는 입자 크기와 이번 실험에서 실제 측정한 입자의 크기의 경향성을 비교해보자.

reference와 실제 실험 결과를 통해서 입자의 크기를 분석한 결과 pH 2.02지점 에서의 입자들의 크기가 매우 크게 관측이 되었으며, 나머지 크기에서는 크기가 매우 작고, 비슷하게 측정이 되었다. pI 지점 근처가 아닌 입자들의 크기는 대부분 비슷하게 측정이 되었으므로 잘 측정이 되었다고 할 수 있다. pI 근처 지점에 대해 이야기를 해보자. pI 지점에서는 콜로이드가 입자들이 전하를 띠지 않으므로 전기영동에 의한 입자의 이동 정도가 매우 낮다. 즉, 입자의 mobility가 매우 낮기에 Dt가 작게 측정된다. 입자 반지름은 mobility와 반비례하기에 pI 지점에서는 입자의 반지름 크기가 매우 크게 측정이 된다. 이번 실험에서 pI는 3.5 근처에서 관찰이 되었는데, Experimental Data graph만 보면 그렇게 측정이 되지 않아 보인다. 하지만, 이는 시간 상의 문제로 Data의 수가 부족했기에 생긴 현상이며, Zeta potential 정보를 얻은 후 pI 지점을 계산해내서, 이 지점과 인근에서의 particle size를 측정해서 correlation graph를 얻으면 reference graph의 개형과 비슷한 모양의 그래프를 얻을 수 있을 것이다. pH 2.02 지점에서는 particle의 surface에 이온/극성 용매가 불규칙하게 부착되어 가상 입자의 크기가 매우 크게 측정이 되었거나, 전기 영동 등에 의해서 EDL의 찌그러져서 측정이 되어 실제 입자보다 더 크게 측정이 되었다고 생각할 수도 있다. 다만, 이 설명은 입자들이 충분히 안정하여 자체적인 거리를 유지할 수 있을 때 가능하지만 zeta potential이 해당 안정성을 보장해줄 수 없기에 다른 설명이 필요하다. 그림 2를 다시 살펴보자. 어떤 colloid system이 stability를 유지하지 못하면 입자들이 거리를 가까이하려 하는데, 이는 2가지 경로를 따라 진행된다. 첫 번째 경로는 입자들이 먼저 뭉친 후 서로의 거리를 가까이하는 Flocculation -> Coagulation -> Sedimentation 경로 (이하, FCS 경로)와 입자들이 거리를 가까이한 후 약간 뭉치는 Sedimentation -> Flocculation -> Coagulation 경로 (이하, SFC 경로)로 구분된다. FCS 경로의 경우 입자들의 크기가 매우 크게 형성이 되며, SFC 경로를 따르면 입자들의 크기가 작게 형성이 된다. Zeta potential의 수치를 보면 DLVO의 Primary Well에 위치하려 하기 때문에 FCS 경로와 SFC 경로를 반드시 거쳤음을 알 수 있다. pH 2.02 지점에서는 입자의 크기가 큰 것을 봐서 FCS 경로를 따라서 형성된 Slurry인 것을 예상해볼 수 있으며, 나머지 pH 지점에서는 입자의 크기가 작은 것을 봐서 SFC 경로를 따라서 Slurry가 된 것을 예상할 수 있다. 이번 실험에서는 측정하지 않았지만 보통 입자와 관련된 실험을 진행하면 입자의 광학적 정보를 같이 측정한다. 만약에 이번 실험에 optical data를 얻어내는 과정이 있었다면 Slurry처럼 입자 사이의 거리를 가깝게 유지하는 것은 같으나, pH 2.02 지점에서는 자갈이 서로 가깝게 쌓여 있는 모양을 하고 있을 것이고, 나머지 지점에서는 모래가 서로 가깝게 쌓여 있는 모양을 하고 있을 것이라고 생각할 수 있다.
3) pH - Particle size - Zeta potential size 사이의 관계 및 실험에 영향을 미칠 수 있는 추가 요인
경향성을 편하게 설명하고자, pH 2.02지점과 나머지 지점을 분리해서 설명하겠다. pH가 낮은 지점에서 particle size가 유독 크게 측정이 되었다. 앞서 이를 EDL의 찌그러짐, FCS 경로에 의한 현상이라고 이야기를 했다. 이는 pH와의 연결고리가 크지는 않다. pH에 의한 효과를 생각해보자면 Steric effect를 생각해볼 수 있다. 그림 9를 살펴보자. pH < pI에서 TiO2의 표면은 산소 하나에 수소 2개가 연결되어 있는 형태를 유지하고 있다. 이는 pI 지점과 pH > pI 지점에서의 TiO2 표면보다 입체적으로 방해가 더 높아서 이온들이 흡착되어 layer를 형성하기 어려워진다. 그렇기에 하나의 안정한 EDL을 형성하기 위해 더 많은 상호작용을 요구하고, 많은 입자들이 넓은 범위에서 관여하기 때문에 입자의 크기가 특별히 크게 측정이 되었다고 예상된다. 실제로 위에서 사용한 Reference Data들을 보면 모두 pH 2 지점에서의 측정을 피하고 pH 3 이상에서 정보들을 얻어낸 것을 확인할 수 있다.
colloid를 포함하는 system은 particle size와 distance among colloids를 구분해서 설명할 수 있어야 하며, 이는 pH의 변화에 의해 설명이 가능해진다. pH 2.02 인근 구간을 제외하면 pH의 단조 증가/감소에 대해 설명하는 것이 아닌, pI로부터 얼마나 pH가 멀리 떨어져 있는 정도를 중요하게 생각해야 한다. pH - pI 가 증가할수록 입자의 전하가 증가하므로 Zeta potential도 증가한다. 이는 Colloid의 안정성이 더 높다는 것을 뜻하므로 Particle의 Size는 더 작은 상태를 유지할 수 있게 된다. 그리고 Zeta potential의 증가는 Particle 사이의 거리도 일정 간격을 가질 수 있는 가능성을 시사한다. DLVO graph에서 primary well과 secondary well 사이의 에너지 준위 차이가 존재하는데, Zeta potential이 증가하면 이 에너지를 넘어서 입자가 Secondary well로 배치될 수 있다. 이 지점은 입자 사이의 거리가 있지만 에너지가 local minimum을 보이고 있는 지점이기 때문에 주변부에 비해 상대적으로 에너지가 낮으며, 안정한 system을 유지할 수 있게 된다. 직접 수행한 실험에서도 pI 인근의 점이 아닌 pH 8.76 -> 9.99 구간에서도 Zeta potential의 절댓값이 0.5 -> 1.2로 증가하고 이에 따라 particle size가 137.0 -> 132.7로 감소하는 것을 관찰할 수 있다.
마지막으로 particle size에 영향을 줄 수 있는 요인들에 대해 생각해보자. 우선 측정에 사용한 sample이 균일하게 섞이지 않았을 수 있다. 측정을 위해 stirring을 멈추면 전하를 갖고 있는 입자들은 서로 엉키게 되어 cuvette내에서 제대로 분산이 안될 수 있다. 또한 system의 이온 강도를 고려해야 한다. pH 조절을 위해서 HCl과 NaOH를 이용하는데, 과도한 이온강도는 더 압축된 EDL을 형성하게 한다. 이는 particle size에 직접적인 영향이 간다. 또한 media의 극성에 따라 입자의 크기가 다르게 측정된다. media가 극성인 경우에는 입자의 크기와 EDL의 크기의 차이가 적다. (Smoluchowski attraction) 반면 무극성 용매를 사용하는 경우 안정화를 위해 이온이 많이 관여하므로 상대적으로 EDL의 크기가 크다. 그리고 기기의 조건 등도 영향을 줄 수 있다. 먼저 pH meter가 pH를 정확하게 측정하지 못할 수도 있다. (또는 정확한 pH 측정까지 필요한 시간보다 짧은 시간 내에 측정을 완료했다고 판단하는 경우) 그리고 SZ-100의 광학적 배열도 영향을 미칠 수 있다. 입도 분석처럼 높은 정확도를 요구하는 실험은 다양한 범위에서의 데이터를 측정하여 Correlation의 정확도를 높이고, 각 수치에서의 측정을 여러 번 진행하여 측정의 정확도/정밀도 등을 개선해야 한다.
Ⅷ. Reference
1. Terence Cosgrove, Colloid Science principles, Methods and Applications 2nd, WILEY, 2010
2. HORIBA, A GUIDEBOOK TO PARTICLE SIZE ANALYSIS, HORIBA INSTRUMENTS, INC., 2019
3. HORIBA, Nanoparticle Analyzer nano partical SZ-100 Series, HORIBA INSTRUMENTS, INC.
4. Tiziana Tosco외 2인, Transport and Fate of TiO2 nanoparticles in soil and aquifers, Politecnico di Torino, 2017
'자료.zip > 화공생명공학전공실험' 카테고리의 다른 글
| Hplc (1) | 2021.02.01 |
|---|---|
| PCR + 전기영동 (0) | 2021.02.01 |
| FT-IR 분석 실험 (0) | 2021.02.01 |
| 접촉각 측정 (Contact Angle) (1) | 2020.12.17 |
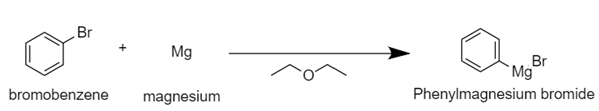
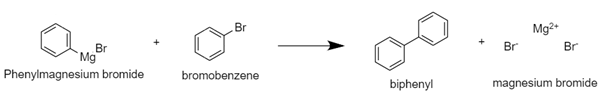
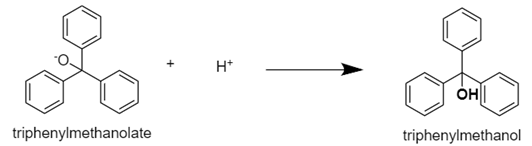
| Grignard Reagent를 이용한 Triphenylmethanol synthesis 실험 (0) | 2020.10.28 |