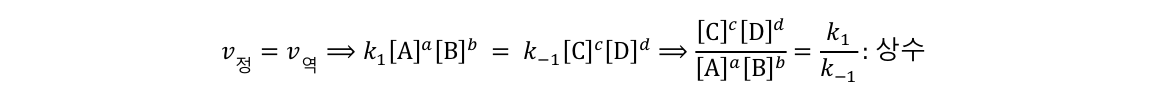Contents
1. 반응물 및 생성물의 농도 변화
2. 부피 및 압력 변화
3. 온도 변화에 따른 평형 이동
화학 반응은 일정 시간이 지나면 평형에 다다른다. 하지만 평형 상태에 놓인 계에 변화를 주면 변화가 해소되는 방향으로 평형의 위치를 변화한다. 특히 농도, 압력, 온도가 변할 때 화학 평형이 변화한다.
1. 반응물 및 생성물의 농도 변화
평형에 놓여 있는 계에서 물질의 농도가 증가하면, 계는 추가된 물질을 소모하는 방향으로 평형이 이동한다. 반면 물질의 농도가 감소하면, 그 계는 감소된 물질을 다시 보충할 수 있는 방향으로 평형이 이동한다. 농도의 변화는 온도 변화가 수반되지 않기 때문에 평형 상수가 기존의 평형 때와 같은 값을 갖는다 반응물과 생성물의 증감에 따라 나타나는 반응의 경향성이 다르므로, 아래의 표를 통하여 어떻게 변화하는지 살펴보자.

2. 부피 및 압력 변화
부피나 압력에 의한 평형의 이동은 평형 상태에의 계가 기체 물질을 하나 이상 포함하고 있어야 한다. 특정 온도의 평형 상태에서 부피의 변화로 압력이 변화하면, 그 변화를 완화하려는 방향으로 다시 평형이 이동한다. 기체의 분자수는 계의 압력을 결정한다. 그러므로 부피와 압력의 변화는 기체 분자수의 변화로 이어진다. 이때 평형 상태가 어떻게 변화할 지는 반응물과 생성물에 포함되어 있는 기체 물질의 반응 계수의 크기 비교를 통해 알 수 있다. 그러므로 같은 경향의 부피와 압력의 변화는 동일한 변화를 야기하지 못하며, 평형 이동을 파악하려는 반응의 반응 계수를 비교하여 우세한 반응을 결정해야 한다. 반응 전후로 기체 분자의 계수 합이 동일하다면, 부피와 압력의 변화는 평형 변화에 영향을 주지 못한다.
한편 계의 부피를 조작하지 않더라도 반응에 관여하는 물질을 추가로 넣으면 부분압력의 변화로 평형을 변화시킬 수 있다. 이는 곧 반응에 관여하지 않는 기체 물질은 계의 전체 압력에만 영향을 줄 뿐, 부분압력에는 어떠한 영향도 미치지 않아 평형을 변화시킬 수 없다. 아래의 표는 반응 전후 기체의 반응 계수의 합이 다른 경우 변화에 대해 평형이 어떻게 이동하는지 정리한 것이다.

3. 온도 변화에 따른 평형 이동
온도에 의한 평형 상태의 변화를 쉽게 이해하기 위해서 반응에서 출입하는 열을 반응물 혹은 생성물로 생각해보자. 흡열반응은 반응을 위하여 열을 사용하기 때문에 열을 반응물처럼 사용하는 반응으로 생각할 수 있다. 반면 발열반응은 반응 결과로 열을 방출하기 때문에 열을 생성물처럼 생각할 수 있다. 이를 화학식에 반영하면 다음과 같다.

온도가 변하면 그 변화를 완화하려는 방향으로 평형이 이동한다. 해당 반응이 흡열인지 발열인지를 고려하면 제공되거나 빼앗긴 열이 평형을 어떻게 이동시킬 것인지 알 수 있다. 예를 들어 흡열 반응의 평형 상태에 열을 가한 경우 반응물(열)이 가해진 것으로 볼 수 있으므로 이를 소모하고자 정반응이 우세해진다. 한편, 농도나 부분압력의 변화는 평형 상수 값에 영향을 주지 못하나 온도에 의한 변화는 평형 상수에 영향을 미친다. 온도 변화에 의한 평형 이동과 변화한 평형 상수를 정리하여 다음 표와 같이 정리할 수 있다.

'전공 개념.zip > 일반화학' 카테고리의 다른 글
| 화학평형과 평형상수 (0) | 2022.04.05 |
|---|