
1. Introduction
산염기 적정을 설명하는 알짜이온 반응식은 다음과 같다.

강산과 강염기에 의한 적정은 위의 반응만 이용하더라도 쉽게 설명할 수 있다. 하지만 적정 과정에서 사용된 물질 중 하나 이상이 약한 이온화 정도를 보이면 결과를 설명하기에 어려움이 있다. 그리고 다양성자산이나 그의 짝염기가 적정에 사용되면 그 결과를 설명하기 더 어려워진다. 이번 실험은 완충용액의 원리를 이양성자산의 적정 곡선을 통해 이해해보는 것을 목표로 한다.
중화 적정에서는 종말점을 결정하는 것이 중요하다. 왜냐하면 종말점을 결정하고 그 점을 당량점으로 결정해야 하기 때문이다. 단순히 당량점을 결정하려면 지시약의 색 변화를 이용할 수 있다. 하지만, 적정의 경향성과 적정 곡선을 그려야 할 때는 어려움이 있다. 보다 정확한 정보를 제공해주는 적정 기구 중 ph meter가 있다. pH meter는 사용하기 전에 적정할 시료와 비슷한 pH를 통해서 교정(Calibration)을 진행해야 한다. 이번 실험에서는 pH가 염기에서 산 순서대로 이동하므로, pH meter를 pH 10 표준용액과 pH 7 그리고 pH 4 순서대로 교정을 진행하는 것이 액간 접촉 전위를 최소화하면서 pH를 측정할 수 있다.
적정 중 발생하는 반응에 대해 살펴보자. 이번 실험에서는 강산 $HCl$을 표준 용액으로 해서 탄산 나트륨($Na_2CO_3$)을 적정하고자 한다. 보다 정확히 말하면 탄산 이온을 적정하는 것이나, 이온은 단일 형태로 존재하지 못하기 때문에 탄산 나트륨을 사용한다. 이번 실험에서는 생성물로 탄산이 형성되나, 적정 중 발생하는 반응들을 이해하기 위해서 탄산 이온의 이온화과정을 살펴보자. 탄산은 이온화될 수 있는 수소가 2개인 이양성자산이다. 이온화 과정은 다음과 같다.

탄산 나트륨은 강전해질이므로 넣은 물질이 모두 이온화되는데, 생성된 탄산이온은 가수 분해를 일으키기에 충분히 강한 탄산의 짝염기이다. 그래서 염의 가수분해를 통해서 수산화이온을 형성한다. 이를 반응식으로 정리해보자.

또한 이산화탄소는 수산화이온에 대해 반응속도가 크고, pH가 클수록 그 정도는 증가한다. 이를 반응식으로 정리해보자.

이 반응은 물에 용해된 이산화탄소가 반응하여 탄산 이온을 증가시키는 것을 의미한다. 이것이 가지는 의미는 조금 뒤에 살펴보도록 하자.
한편, 탄산 나트륨 때문에 적정 전의 용액은 나트륨이온($Na^+$), 탄산 이온($CO_3 ^{2-}$), 중탄산이온($HCO_3 ^-$), 그리고 수산화 이온($OH^-$)이 존재한다. 이때 탄산 이온과 중탄산이온은 짝염기 짝산 관계에 놓여있어서 완충 용액으로 작용할 수 있다. 이 상태의 용액의 완충 작용을 살펴보자.

산 염기로 적정을 진행하므로 산 첨가시 발생하는 완충 효과가 발생한다. 산을 충분히 넣어주면 탄산 이온이 모두 반응하여 해당 용액이 완충 작용을 수행하지 못하게 된다. 그 다음에는 pH가 급변하는 구간이 나타난다. 앞서 이산화탄소가 용해되어 탄산이온이 될 수 있음을 살펴보았다. 이는 용액이 완충효과를 넣어준 탄산나트륨의 양에 비해 더 많이 발생하도록 하여 적정의 정확도가 떨어진다. 탄산이 이양성자산이기 때문에 그의 짝염기도 적정을 할 때 2번의 당량점이 나타난다.
두 번째 적정 과정 에서는 나트륨이온($Na^+$), 중탄산이온($HCO_3 ^-$), 그리고 수산화 이온($OH^-$)이 존재한다. 이때 적정을 위해서 $HCl$을 넣으면 중탄산이온과 수소 이온이 반응하여 탄산이 형성되며 완충 용액으로 작용할 수 있다. 이 상태의 용액의 완충 작용을 살펴보자.

마찬가지로 염화수소를 이용해서 적정을 진행하므로, 완충 용량을 벗어난 산의 양을 넣기 전까지 산첨가 완충 작용이 발생한다. 충분한 양의 산을 넣어서 완충 작용이 작용하지 못하게 되면 pH가 H의 변화에 민감하게 변한다.
만약 각 구간에 대해서 pH를 구하고 싶으면 HH 식(Henderson–Hasselbalch equation)과 산과 염기의 해리 상수의 관계, pH와 pOH의 관계를 이용하면 된다. 하지만, 이 적정은 한 표준 용액에 대해 2개의 당량점을 가지므로 각 구간에 해당하는 산의 해리 상수를 이용해야 한다.

이번에 고려하는 반응들의 반응 계수는 모두 1로 동일하다. 그렇기에 실험이 이상적으로 진행되었을 때를 가정하면 아래의 결과를 얻는다.

따라서 첫 번째 구간에서는 $pH=pK{a,2}$, 두 번째 구간에서 $pH=pK_{a,1}$임을 알 수 있다.
2. Chemicals & Apparatus
1) Chemicals

2) Apparatus
50mL 뷰렛, 100mL 비커, pH meter, 완충용액(buffer solution), Stirring bar, stirrer, Stand, Clamp
3. Procedure
실험 1
1) 0.10M $HCl$ 용액으로 50mL 뷰렛을 눈금 끝까지 채운다.
2) 100mL 비커에 피펫으로 0.10M $Na_2CO_3$ 20.0mL를 넣고 Stirring bar를 이용해서 저어준다.
3) pH meter의 전원을 키고 표준 완충 용액으로 pH meter을 보정한다. (실험 2)
4) ‘실험 결과’ 표에 지시된 만큼씩 HCl 용액을 비커에 넣어준 후 Measure 버튼을 눌러 측정을 시작한다. pH meter가 안정해질 때까지 기다린 후 pH값을 기록한다. (pH 측정이 완료되어 안정해지면 화면에 표기가 stabilizing에서 ready로 바뀜) 뷰렛에 50mL를 모두 사용할 때까지 반복한다.
이때 초기에는 stirring bar의 회전 속도를 천천히 하며 실험을 진행한다, (초기 탄산염 수용액의 pH는 염기성이므로 대기 중 $CO_2$가 용액으로 들어가는 속도가 빠르기 때문)
실험 2
1. pH meter Calibration - 1
1) 전원을 켠 뒤, pH 4.00, 7.00, 10.00 buffer solution을 준비한다.
2) F1을 누르면 Calibration 과정이 시작된다.
3) 전극을 증류수로 잘 닦은 후 pH 4.00 buffer solution에 넣은 뒤 F3을 눌러 Calibration을 진행한다.
4) <Reading is stable> 표시가 나타나고 pH가 제대로 나오면 F2를 눌러 값을 저장한다.
5) pH 7.00, pH 10.00 buffer를 이용해서 3~4번 과정을 반복한다.
2. pH meter Calibration - 2
1) 전원을 켠 뒤, pH 4.00, 7.00, 10.00 buffer solution을 준비한다.
2) pH meter의 전극을 꺼내 증류수로 씻은 뒤 킴테크 와이퍼로 닦는다.
3) 전극을 pH 4.00 buffer solution에 넣은 뒤 Cal 버튼을 눌러 Calibration을 진행한다.
4) pH=4.00으로 나오면 다시 전극을 꺼내 증류수로 씻은 뒤 킴테크 와이퍼로 닦아준다.
5) pH 7.00, pH 10.00 buffer를 이용해 3~4번 과정을 반복한다.
<pH meter 주의사항>
1. 유리 전극의 끝 부분에 있는 막은 손상되기가 쉬우므로 용액을 젓는데 사용하거나 전극을 흔들지 말아야 한다.
2. 유리 전극 표면은 증류수로 씻어주고, 전극 표면은 항상 젖은 상태를 유지해야 하므로 증류수나 pH 7의 완충용액에 담가 놓는다. (유리전극을 휴지로 닦지 말 것)
3. 전극을 뒤집으면 전극 안의 용액이 흘러나올 수 있으므로 절대 뒤집지 않는다.
4. Stirring 바가 돌면서 유리 전극을 건드리면 고장이 날 수 있으므로 stirring bar와 떨어져서 측정하도록 한다.
5. pH meter 사용 후 반드시 전극을 보존 용액에 넣어 놓을 수 있도록 한다.
4. Data & Results


1) 적정 시작 전 용액의 pH
(1) 이론적으로 구해지는 적정 시작 전 용액의 pH

(2) 오차율

2) 1차 완충 구간
(1) HCl 9mL 지점에서의 용액의 pH
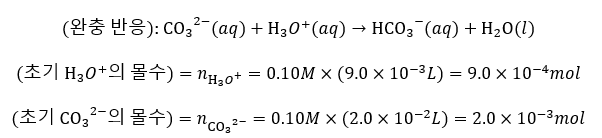
* 초기에 탄산 이온의 반응으로 양이 줄었다고 생각할 수 있지만, 반응이 진행되지 않았다는 가정 하에 계산을 진행하였다. 이 이유에 대해서는 후에 Discussion에서 살펴보겠다.
반응 계수비에 따라서

반응이 진행되는 system의 부피가 일정하므로

(2) 오차율

3) 1차 당량점
(1) 이론적인 상황에서 1차 당량점의 pH
일반적인 산-염기의 적정과 달리 이 반응은 이양성자산의 짝염기와 강산에 대한 적정이기에 1차 당량점에서는 특이한 현상이 관찰된다. 이 적정의 1차 당량점에서는 중탄산이온($HCO_3^-$)이 과량으로 존재한다. 이 물질은 양쪽성 이온으로 물과 반응했을 때 산과 염기로 모두 작용할 수 있다.


이 식으로 중탄산이온에 대하여 반응이 진행되면 $[H_2CO_3]=[CO_3^{2-}]$임을 알 수 있다. ⋯ ①
한편, 탄산은 이양자성산이기에 수소 이온을 2번 내놓으면서 이온화 한다.

종합적인 반응에 대해 평형 상수를 구할 수 있다.

식 ①과 식 ②를 이용하면 다음 관계를 얻을 수 있다.

반응이 종결한 $HCl$ 20mL 지점에서의 pH를 구하면 다음과 같다.

(2) 오차율

4) 2차 완충 구간
(1) HCl 30mL 지점에서의 용액의 pH
1차 당량점에서 중탄산이온의 몰수는 $n_{CO_3^{2-}}$와 같으며 그 값은 $2.0\times 10^{-3} mol$이다.
한편, 특정 지점에서의 반응 부피는 동일하므로 반응이 진행한 후 $n_{CO_3^{2-}}=n_{HCO_3^-}$인 지점에서 두 물질의 농도비가 1로 관찰된다.

양적 관계에 따르면, $x=n_{HCO_3^-}=1.0\times10^{-3} mol$이므로 추가로 필요한 염산의 부피를 계산할 수 있다.

1차 당량점까지 HCl이 20mL이 사용되었으므로 HCl 30mL 지점의 pH를 비교하면 된다.

(2) 오차율

5) 2차 당량점
2차 당량점은 HCl이 40mL 들어간 지점에서 발생하므로 반응계의 부피 $V_{rxn}=20+40=60mL$에 해당한다.

양적관계에 의하여 $M_{HCO_3^-}=M_{H_2CO_3}=0.033M$임을 알 수 있다.
한편, 탄산은 물에서 이온화가 될 수 있으나, 2차 이온화는 거의 발생하지 않아 1차 이온화에 의한 값을 기준으로 한다.

생성된 $H_3O^+$의 농도를 $x$라고 할 때 다음 관계가 성립한다.

2) 오차율

5. Discussion
1) 실험 과정의 이해
적정 시 종말점을 결정하는 것은 중요하다. 지시약의 색 변화를 보면 종말점을 비교적 쉽게 판단할 수 있다. 하지만, 이번 실험에서는 종말점을 결정하는 것 보다 적정의 과정에 따라 형성되는 적정 곡선의 경향성을 파악하는 것이 더 중요하다. 그래서 적정 과정의 정보를 판단할 수 있는 pH meter를 이용했다. pH meter를 사용하려면 먼저 보정(Calibration)과정이 필요하다. 왜냐하면 보정을 통해서 pH meter를 교정해야 측정하고자 하는 용액의 pH를 정확하게 측정할 수 있기 때문이다.
적정을 위해서 적정 장치를 설치했다. 우선 뷰렛에 표준 용액 0.10M HCl 용액을 넣었다. 이때, 정확한 부피 측정을 위해서 마개 하단부까지 HCl 용액이 꽉 차도록 했다. 그 다음에 비커에 stirring bar와 pH meter를 설치했다. 이때 stirring bar에 의하여 pH meter의 전극이 손상되지 않도록 pH 전극을 수직으로, 벽면에 최대한 붙여서 설치했다. 이를 정확하게 보기 위하여 왼쪽에서 사진을 찍은 것이 그림 10이다. 한편, 탄산 이온의 특성으로 인해 생성된 수산화이온 때문에 대기중의 이산화탄소가 중탄산이온 및 탄산 이온으로 전환되어 pH에 영향이 갈 수 있으므로. stirring bar의 속도를 최대한 낮게 하여 대기 중의 이산화탄소가 쉽게 반응하지 못하도록 했다. 적정 장치를 설치한 후 제공받은 Data sheet에 따라서 HCl 용액을 넣고 pH를 측정했다. 적정을 시작하기 전 탄산 이온이 물과 반응해서 넣어준 탄산 나트륨으로 인해 생성된 양보다 더 적은 탄산 이온이 존재한다. 하지만, 수소 이온과 탄산 이온이 반응하면, 그 반응 계에서 탄산 이온의 농도가 감소한다. 탄산 이온은 아래의 반응을 보일 수 있다.

이는 반응의 평형을 깨는 것과 같으므로 르 샤틀리에의 원리에 따라 탄산 이온의 소비에 반대되는 방향으로, 즉 역방향으로 평형이 다시 이동한다. 그러므로 탄산 이온이 다시 형성되며, 결국 초기에 넣어준 탄산의 양만큼 적정에 참여하게 된다. 다만 첫 번째 완충 구간에서 르 샤틀리에의 원리로 탄산이온이 형성되며 초기에 형성된 수산화이온이 거의 다 소멸한다. 그래서 첫 번째 당량점이 지나면 수산화 이온이 반응계에 거의 존재하지 않아 대기중 이산화탄소가 중탄산이온 혹은 탄산이온으로 변화하는 효과가 거의 무시할 만할 정도로 작아진다. 그래서 각 단계마다 측정을 진행하다가 pH가 7보다 약간 큰 수치를 보이면, 첫 번째 완충 구간이 종결되었다고 판단하여 stirring 속도를 올려 더 용액의 혼합과 반응을 도와 정확한 pH를 측정하고자 했다. 한편, 적정은 양적 관계가 중요시되는 실험이므로 각 단계별로 메니스커스를 최대한 맞추어 용액을 넣으려고 했다.
2) 실험 결과 및 오차 원인 분석
넣어준 HCl 용액에 따른 pH 변화를 표로 기록했고, 이를 geogbra 프로그램을 이용해서 적정 곡선을 표현했다. (함수의 형태로 만들어서 매끄럽게 만들고자 했으나, 그래프의 개형이 이상하게 나와서 선의 형태로 이어 경향성을 파악했다.) 또한, 계산을 통해서 중요한 부분들에 대해서 이론적으로 나왔어야 하는 값들과 실제 실험값 사이의 차이를 표로 정리해보았다.

각 완충 영역에서 완충 효과가 최대로 나타나는 지점을 골라 pKa값과 비교를 했다. 다만, 첫 번째 완충 구간에서 완충 효과가 최대로 나타나는 지점인 10mL 지점에서의 측정 수치가 없었기 때문에, 그 지점과 가장 인접한 9mL 지점에서의 pH를 비교했다. 실험 결과 각 단계의 당량점에서의 오차율이 다른 지점들의 오차율보다 더 큰 것을 확인할 수 있다. 당량점 근처에서 완충 효과가 종료되어 pH가 급변하기 때문 일 수도 있으며, 반응이 종결되고 다른 반응으로 넘어가는 단계이기 때문에 pH가 정확한 값보다 멀어진 쪽에서 측정될 수 있다. 또한 각 당량점마다 구별되는 차이점 또한 오차율이 크게 발생하는 데 기여할 수 있다. 첫 번째 당량점에서는 중탄산 이온이 과량으로 존재한다. 그래서 아래의 반응이 일어난다.

이 반응의 생성물 또한 물과 반응하여 수소이온을 혹은 수산화이온을 내어놓을 수 있기 때문에 pH가 이론값과는 다른 값으로 측정될 가능성이 더 높다. 그리고 두 번째 당량점의 생성물인 탄산은 물과 반응하여 수소 이온을 다시 내어놓을 수 있다. 탄산의 이온화 과정 중 2번째 수소 이온을 내어 놓는 반응은 잘 발생하지 않는 것으로 생각해 이론값을 구했다. 하지만 반응계의 상황에 따라 충분히 두 번째 이온화도 발생할 수 있으며, 이는 pH에 영향을 줄 수 있다. 그렇기에 당량점에서의 pH는 다른 지점보다 큰 오차율을 보인다.
위의 원인들 외에도 이번 실험에서 정확도를 낮추는 데 관여한 여러가지 요인들이 존재한다. 우선 첫번째 완충 구간부터 첫 번째 반응 완결까지 수용액속에 남아있던 수산화이온에 의한, 그리고 이 때문에 녹아든 대기 중의 이산화탄소에 의한 pH 변화가 정확도에 영향을 주었다. stirring bar를 천천히 돌려 이산화탄소가 적게 녹았더라도 실험의 규모를 고려했을 때 약간의 변화에도 의미가 있는 변화가 생길 수 있다. 보다 정확한 pH 값을 계산하려면 용액의 바로 위에 떠있는 공기의 양에 포함된 이산화탄소의 양, 표면 장력으로 인해 증가한 용액의 면적, 실제 반응에 참여하는 이산화탄소의 양 등 너무 복잡한 요소들을 고려해야 하며, 이를 직접 측정하고 계산해내기에는 어려움이 존재한다. 이는 정확한 pH 값을 계산해내기 힘들게 하며 오차를 발생시킨다. 또한 HCl 용액을 넣고 측정을 바로 진행한 것 또한 오차가 발생하게 할 수 있다. HCl이 용액에 들어가고 정확한 pH를 측정하기 위해서 2가지 조건이 요구된다. ① 각 적정 단계마다 들어가는 HCl 용액의 양이 적기 때문에 적정을 위해 이 용액을 넣었을 때 기존 용액에 분포하고 있던 모든 탄산이온과 반응하기 위해서 충분히 용액이 섞일 때까지 기다려야 한다. ② 용액이 충분히 혼합되고 반응하기까지 시간이 필요하다. ②는 반응 시간이 충분히 빠르기에 pH에 영향을 주지 않지만, ①이 충족되기에는 꽤 시간이 걸리며, 표준 용액을 넣을 때마다 같은 양에 대해 동일한 시간간격으로 맞추어 pH 측정을 해야 더 정확한 측정을 할 수 있다. 하지만 이 점을 고려하지 않았기 때문에 각 측정마다 값이 정확하지 않을 수 있다. 또한 앞서 교정들을 진행을 했기 때문에 큰 영향은 없겠지만, 실험 직전에 pH meter를 보정하지 않았기 때문에 영향이 오차를 발생하는 데의 원인이 될 수 있다. 그리고 pH 측정 단계 이전에, 적정을 설계할 때 자체에도 여러 문제점들이 측정의 정확도에 영향을 줄 수 있다. 우선 뷰렛의 교정도 이루어지지 않았으며, 전 실험자들이 세척을 어떻게 했는지도 파악할 수 없기 때문에 뷰렛으로 정확한 부피를 옮겼다고 하기에는 어려움이 존재한다. 그리고 표준용액으로 사용한 HCl의 농도가 정확히 0.10M이 아닐 수도 있다. HCl은 물에서 이온화가 잘 되는 물질 중 하나에 속한다. 하지만 앞서 ‘산화 환원 적정 실험’에서 진행했던 것처럼 표준 용액의 표준화를 진행해서, 실험실에서 사용하는 HCl 용액의 정확한 몰 농도를 구한 후 탄산 이온 적정에 사용했어야 보다 정확한 결과값을 얻을 수 있었을 것이다.
Ⅷ. Reference
1. 대한화학회, 표준 일반화학실험 제 7판, 천문각, 2011, pp. 121~131
2. Brown 외 5인 및 화학교재연구회 옮김, 일반화학 제 14판, Pearson 및 자유아카데미, 2019, pp. 718~724, 728~732, 750~754, 772~794
3. Gary D. Christian 외 2인 및 분석화학교재연구회 옮김, 분석화학 제 7판, Wiley 및 자유아카데미, 2015, pp. 389, 393, 401~405
실험 결과 해석을 위해 필요한 개념
산과 염기의 상대적인 세기
짝산-짝염기 쌍
공통이온 효과와 완충용액
염의 가수분해
다양성자산
중화적정의 개념과 그 종류
pH meter