1. 단백질의 구조와 기능 (Proteins Structures and Function)
1) Intro
- 단백질은 천연형 입체구조(native conformation)을 갖고 있음
-> 수많은 구조들 중 생물학적 활성(biology activity)을 보이는 몇 안 되는 구조
- 전체적으로 보면 무작위 구조(random structure)으로 보일 수 있으나, 단백질을 구성하고 있는 subunit의 구조는 규칙적임
2) 단계별 단백질의 구조
① 1차 구조 (primary structure)
- 단백질의 가장 기본적인 단위를 말함
- 공유결합에 의해 서로 일렬로 연결되어 있는 아미노산의 서열
② 2차 구조 (secondary structure)
- 펩타이드 골격에 있는 원자들의 공간적인 배열
- 아마이드의 N-H와 펩타이드 골격의 카보닐기 C=O가 서로 수소결합으로 연결되어 있음
- alpha-나선(helix)구조와 beta-병풍(sheet)구조
- 도메인(domain)/초2차구조(supersecondary structure): 단백질에서 결합이 독립적으로 일어난 부분
- grouping을 하면서 고유의 구조를 가짐
e.g. alpha - alpha / alpha - beta - alpha / …
③ 3차 구조 (tertiary structure)
- 단백질에 포함되어 있는 모든 원자의 3차원적 배열을 말함
- 보결분자단(prosthetic group, 아미노산 X 원자단) 사이의 배열(상호작용)도 포함
e.g. 이황화결합
④ 4차 구조 (Quaternary structure)
- 소단위체(subunit)들의 서로에 대한 배열
: 단백질을 구성하는 폴리펩타이드 사슬
- subunit 사이의 수소결합, 정전기적 상호작용, 소수성 상호작용 등으로 매개
2. 단백질의 1차 구조 (Primary Structure of Proteins)
1) 1차 구조(아미노산 서열) 식별의 중요성
- 단백질의 1차 구조를 따라 3차 구조가 결정되고, 이는 단백질의 성질을 결정함
- 단백질이 올바른 기능을 하려면 올바른 3차 구조가 필요함 (biology activity는 3D structure dependent)
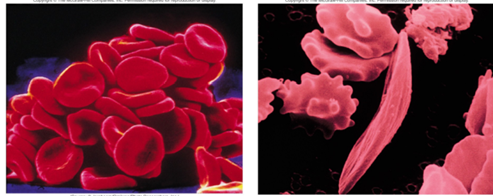
2) 단백질의 아미노산 서열과 겸상적혈구빈혈증(sickle-cell anemia)
- 헤모글로빈의 단백질 구조의 돌연변이로 관찰되는 유전병 (헤모글로빈이 산소를 결합하지 못함)
- 적혈구의 모양이 낫 모양이기에 잘 안 흐르고 혈관 중간에 걸려서 혈액순환이 잘 발생하지 못함
① illustration
② 유전자 - 단백질 돌연변이 (Gene - Protein Mutation)
- 단백질의 정보는 유전자에 암호화 되어있으므로 유전자 차원에서 문제가 생겨서 단백질구조에 문제가 생기는 것
ⅰ) 유전자 돌연변이 (gene-scopic mutation)

- 정상적인 세포는 글루탐산(Glutamate, E)의 정보를 암호화하고 있음 (CTC -> GAG-> mRNA: GAG)
- Sickle 세포는 발린(Valine, V)의 정보를 암호화하고 있음 (CAC -> GTG -> mRNA: GUG)
ⅱ) 단백질 돌연변이
- 헤모글로빈은 16th 염색체의 alpha-alpha subunit과 11th 염색체의 beta-beta subunit으로 구성
- 겸상적혈구빈혈증의 경우 11th 염색체에 문제가 생긴 것
- normal cell HbA은 우성 유전자이며 sickle cell HbS는 열성 유전자
-> 열성-열성 조합일 때 겸상열성적혈구 증후군이 나타나며 나머지 조합에 대해서는 나타나지는 않음
- Glu는 acidic amino acid이며 Val은 neutral amino acid이기에 정전기적 전하에 차이가 존재하고 이는 3차원적 구조의 차이에 영향을 미침
- 11th 염색체 중 6번재 아미노산에 돌연변이가 생기는 것
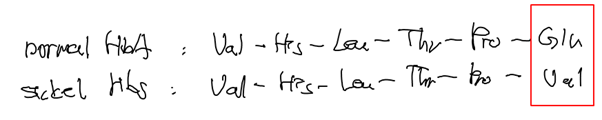
3) 1차 구조의 결정 및 관찰
- 부위지향성 돌연변이유발법(site-directed mutagenesis)을 이용해서 1차 단백질 변화와 단백질 기능의 차이를 비교함
- 단백질의 임의의 아미노산에 변화를 주어 생물학적 활성 변화를 체크함
-> 아미노산 치환 결과는 약간의 차이부터 막대한 차이까지 다양함
- 고전 생화학에서 단백질 아미노산의 결정은 일상적이지만 사소한 작업은 아니기에 조심스럽게 결정되어야 함
3. 단백질의 2차 구조 (Secondary Structure of Protein)
- 단백질의 2차 구조: 단백질 골격의, 폴리펩타이드 사슬의 수소결합 배열을 말함
-> 펩타이드 구조에 포함된 펩타이드 결합이 결정적인 역할을 함
1) 펩타이드 결합의 구조

- 펩타이드 결합에서는 회전이 자유로운 부분과 그렇지 못한 부분으로 구분됨
① 회전이 자유롭지 못한 부분
- 펩타이드 결합: 공명구조(resonance)의 형성으로 인하여 다중결합과 같은 효과를 갖게 되어 회전으로부터 자유롭지 못함
-> 펩타이드 결합을 포함하여 최대 6개의 원자(카르보닐기 + 아미노기 + 2 alpha carbon)가 한 평면위에 올 수 있는데, 이를 아마이드 평면(amide plane)이라고 부름
② 화전이 자유로운 부분 (-180° ~ 180°, 라마찬드란 각)
- 기준이 되는 R - alpha C - H에 대해 양 옆의 결합은 화전이 자유로움
i.e. R이 연결된 alpha C와 amide plane을 연결하는 결합은 회전이 자유로움
ⅰ) 파이 회전 (phi rotation, Φ): alpha C와 amino group의 N 사이의 결합이 회전하여 생기는 각
ⅱ) 프사이 회전 (psi rotation, Ψ): alpha C와 carbonyl group의 C 사이의 결합이 회전하여 생기는 각
-> 규칙적인 2차 구조는 Φ와 Ψ의 값이 각각 같은 값으로 반복이 됨
2) α-나선 (α-helix)

① 한 아미노산의 카보닐기(C=O)와 다른 아미노산의 아미노기(N-H)와 수소결합을 형성
② counting 기준
- peptide group(amide plane) 기준: n번째 C=O와 (n+3)번째의 N-H
- alpha carbon 기준: m번째 C 오른쪽의 C=O와 (m+4)번째 왼쪽의 N-H
- 앞으로 말할 아미노산 1개는 연두색으로 표현한 N - alpha C - carbonyl C를 기준으로 논의할 것
③ 단위
- 옴스트롱 (1A): 1A = 10-8cm = 10-10m = 10nm = 1000pm
④ 기하적 정보
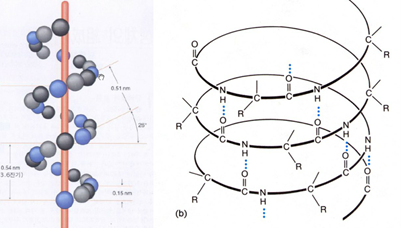
- 나선 한 바퀴에는 아미노산 3.6개가 포함되어 있으며, 이 길이는 0.54nm (5.4A)
- 이 회전은 C=O와 N-H가 나선 축에 평행하고 일직선으로 수소결합을 유지하기 때문에 안정한 형태를 유지할 수 있음
- 곁사슬 R은 나선으로부터 outward하게 배향을 하고 있음
- 한 아미노산에는 하나의 R을 포함하고 있기 때문에 나선 한 바퀴에는 3.6개의 R이 포함되어 있음
⑤ 예시
- 단백질 내에서 alpha helix의 함량은 0% ~ 100%까지 매우 다양함
- alpha helix의 함량이 높은 단백질의 예시
ⅰ) beta - 헤모글로빈 소단위체 (beta hemoglobin subunit)

- 척추동물 속에 있는 헤모글로빈
- 헤모글로빈의 subunit이며 각 subunit에는 ‘Hem’이 포함되어 있어 산소를 저장하고 운반할 수 있음
ⅱ) 마이오헴에리스린 (myohemerythrin)

- 무척추동물 속에 있는 헤모글로빈
⑥ alpha helix의 파괴: 예시와 원리를 같이 기억하기
- 지금까지는 정상 alpha 나선구조를 살펴봤으며, 지금은 파괴될 수 있는 구조를 살펴보자
- 즉, alpha helix 구조가 거의 존재하지 않는 단백질에 대해 논의할 것
- alpha 나선구조가 파괴될 수 있는 요인에는 여러가지가 있음
ⅰ) 고리구조 (cyclo-structure)
- 프롤린 (proline, Pro, P)

- 곁사슬이 고리 구조이며 아미노기 N을 포함하고 있기 때문에 기본적인 골격이 굽은 형태이기에 아래의 이유로 alpha helix구조에 적합하지 못함
a) 파이 회전(Φ)이 발생할 수 없음
b) 아미노기의 N이 수소결합에 참여할 수 없음
ⅱ) 정전기적 반발력 (electrostatic repulsion)
- 동일한 부호의 전하를 띤 작용기가 포함된 아미노산들이 서로 인접할 때 발생
- 극성을 띠는 아미노산 중 전하를 갖는 산/염기 아미노산에 대해 이 현상이 주로 관찰
e.g. 산 아미노산 사이의 반발력: 아스파트 산 (Asp, D) & 글루탐산 (Glu, E)
e.g. 염기 아미노산 사이의 반발력: 라이신 (Lys, K) & 이르지닌 (Arg, R)
ⅲ) 입체장애 (steric effect)
- 앞서 언급했듯이 곁사슬 R들은 outward하게 단백질 구조를 형성하기 때문에 곁사슬의 크기가 큰 아미노산이 서로 인접할 때 발생
- R에 포함된 beta carbon에 결합된 원자들 중 2개가 수소가 아닌 다른 원자인 경우 R의 부피가 매우 켜지기에 입체장애가 발생할 수 있음
e.g. 발린 (Val), 아이소류신 (Ile), 트레오닌 (Thr)
3) β-병풍 (beta - sheet)
① 펩타이드 골격이 거의 펼쳐져 있는 형태로 존재함
② 수소 결합의 종류
- 마찬가지로 C=O와 N-H 사이의 수소 결합을 통해서 결합을 이룸
ⅰ) 사슬 내 결합 (intrachain bond)
- 한 사슬 내에서 다른 두 부분이 서로 인접하여 형성되는 수소결합
ⅱ) 사슬 간 결합 (interchain bond)
- 한 사슬과 다른 사슬 사이에 형성되는 수소 결합
③ 구조의 종류
ⅰ) 평행형 병풍 구조 (parallel pleated sheet)
- 모든 사슬이 N 말단 -> C 말단 방향일 때
ⅱ) 역평행 병풍 구조 (antiparallel pleated sheet)
- 사슬이 N 말단 -> C말단과 C 말단 -> N 말단이 혼합되어 있을 때
- C=O와 N-H가 일직선에 배치될 수 있기 때문에 강한 수소결합을 보여 더 안정화된 구조를 가짐
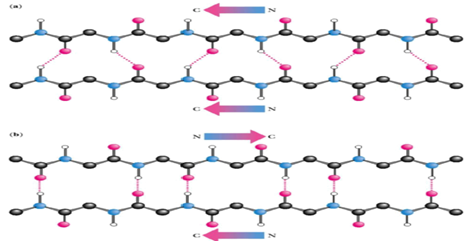
- 단백질의 사슬 방향과 수직하게 수소결합이 형성
4) 규칙적인 구조 내의 불규칙성 (Irregularities in regular structures)
- alpha 나선 구조와 beta 병풍 구조를 제외하고도 단백질 내에서는 다른 나선구조도 발견됨
- 이들은 아예 무작위해 보일 수 있지만 사실 alpha 나선 구조와 beta 병풍 구조의 규칙적인 성질이 파괴된 구조임
① 310 나선
- 한번 회전에 아미노산이 3개가 있으며 원자 10개가 포함되어 있는 구조
cf) alpha 나선구조: 한번 회전에 아미노산이 3.6개 원자가 11개 포함되어 있는 구조
- 이와 비슷하게 27, 416 등이 있음
② β-부푼구조 (β-bugle structure)
- 역평행 beta sheet 구조에서 발견되는 구조이며, 반복적이지 않은 불규칙 구조
- 원래는 사슬 간의 아미노산은 1대 1로 수소 결합을 형성하는데, 부푼 구조의 경우 한 사슬의 아미노산 2개와 다른 사슬의 1개가 결합에 관여하여 2대 1 수소 결합을 보임

- G-1 부푼 구조는 분자 내 수소결합이 형성된 것이고 넓은 부푼 구조는 기본 부푼 구조에 비해 결합에 관여하지 못한 아미노산이 더 넓은 수소결합 사이에 배치된 형태를 말함
③ 역선회 (reverse turn)
- 단백질이 접하려면 펩타이드 골격과 2차 구조의 방향이 바뀔 수 있어야 함
- 때로는 이러한 전환이 발생할 때 기존의 2차 구조가 다른 2차 구조로 변형되고, 이를 역선회 구조라고 함

a) 제 1형 역선회: 잔기 3에서 곁사슬이 바깥에 놓여있어 어떠한 아미노산, 즉 임의의 곁사슬이 배치되어도 됨
b) 제 2형 역선회: 잔기 3에서 곁사슬이 180도 회전해서 안쪽에 놓여있게 되어 사슬의 방향이 바뀜. 이 자리에는 글라이신(gly, G)’만’ 배치될 수 있음 (나머지 곁사슬들은 steric effect가 너무 큼)
c) 제 2형 역선회: 잔기 2에서 프롤린(Pro, P)가 배치될 수 있고 잔기 3에는 글라이신이 배치되어있는 구조
5) 초 2차 구조와 도메인 (Supersecondary Structures and Domain)

a) beta - alpha - beta
b) alpha - alpha
c) beta meander
d) Greek key
- 모티프(motif): 초 2차 구조가 반복되어 나타난 구조

- 모티프는 비슷한 형태를 갖고 있더라도 다양한 기능을 가진 단백질 및 효소에 포함되어 있기 때문
- 도메인(domain): 단백질의 기능을 분류할 수 있는 최소 단위
- 비슷한 기능을 하는 단백질은 아미노산의
6) 콜라겐 3중나선 (The collagen Triple Helix)
- 콜라겐: 뼈와 결합조직의 구성 성분이며 척추동물에 가장 풍부함
- 3개의 폴리 펩타이드 사슬이 반복되어 구성되어 있음
- X - Pro - Gly // X - Hyp - Gly (more stable)
- X: 임의의 아미노산 and Hyp: 하이드록시프롤린 (hydroxy-Pro)

- hyroxy-Pro: 아미노산이 서로 연결되어 아미노산이 연결되어 단백질이 된 후 수산화효소에 의해 변형이 되어 생성됨
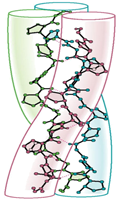
- 위의 3차 helix 구조를 살펴보면 3번째 펩타이드의 곁사슬 R은 항상 안쪽으로 배향되어 있으며 만약 너무 큰 작용기가 붙으면 입체장애가 지나치게 큼 (역선회 구조)
-> 3번째 펩타이드 서열에 항상 글라이신 Gly가 오는 것을 알 수 있음
- 위의 helix 구조는 alpha helix는 아니며 트로포콜라젠(tropocollagen)[[1]]으로 구성이 되어 있음
- 하이도록시프롤린과 하이드록시라이신 사이의 수소결합이 있으며 큰 덩어리의 분자량은 300,000정도 (-OH가 포함되어 있기 때문에 콜라겐을 더 안정하게 만들어 줄 수 있음)
- 콜라젠 속의 라이신 또는 히스티딘이 반응을 하면 새로운 공유 결합을 형성하기에 분자의 나이가 증가함에 따라 질겨지는 경향을 보임[[2]]
7) 두 종류의 단백질 입체구조 (Two Types of Protein Conformations)
① 섬유상 단백질 (fibrous protein)
- silk: beta sheet로 주로 구성이 되어 있음
- wool: alpha helical로 주로 구성이 되어 있음
② 구형 단백질 (globular protein)
- 골격 자체가 접혀져서 공 모양과 같은 형태를 하고 있음
- 수용성이고 촘촘한 구조
4. 단백질의 3차 구조 (Tertiary Structure of Proteins)
1) 3차 구조에 관여되어 있는 힘: noncovalent interactions
- 2차 구조에 비해 더 복잡한 구조를 갖고 있기에, 다른 추가적인 힘이 관여함. 그렇기에 더 안정하고 낮은 에너지를 보유할 수 있음
- 단백질을 구성하고 있는 subunit 사이의 수소결합에 ‘비공유성 상호작용’이 추가적으로 관여함
e.g. 소수성 상호작용 (hydrophobic interaction), 정전기적 상호작용 (electrostatic attraction), 금속 이온 상호작용, 이황화결합 (Disulfide bond)[[1]] 등

- 특정 단백질에 위에서 언급한 모든 상호작용이 관여해야 한다는 것은 아니며, 해당 단백질에서 보여질 수 있는 모든 상호작용이 관여해서 3차 단백질을 형성한다는 것을 뜻함
i.e. 위에서 언급한 상호작용의 조합을 통해서 상호작용이 형성
2) 단백질 3차 구조의 결정
① X선 결정학[[1]]
- 조건이 잘 조절되었다면 특정 단백질을 완벽한 형태의 결정을 얻어낼 수 있으며, 이때의 구조는 동일한 3차원 입체구조와 방향성을 갖고 있음
- 분자 내의 전자가 X선을 산란하면 사진판 및 방사능 측정기에 회절 패턴이 형성됨 (전자가 많을수록 산란의 정도가 증가함)
- 산란된 정보를 푸리에 급수를 통해 분석을 하고, 이 정보를 바탕으로 3차 구조를 추론할 수 있음
② 핵자기공명분광학 (2D-NMR)
- 많은 측정 자료를 얻고 이 자료를 컴퓨터로 분석해서 분자 구조를 얻어냄
- 수용액 상태의 시료를 사용해서 분석을 진행
3) 마이오글로빈 (Myoglobin)
- 마이로글로빈은 3차 단백질을 설명할 때 대표적으로 사용하는 구형 단백질
: X ray 결정학 방법을 이용해서 구조를 결정한 첫 번째 단백질
① 구성
- 153개 아미노산 잔기 + 헴(heme, 보결분자단)
② 외부 단백질 골격
- 8개의 alpha helix(A~H)를 전체 75%만큼 갖고 있으며 beta sheet는 존재하지 않음
- 극성 곁사슬은 outward하며 단백질 내부는 단백질 inside에 배치
cf) 히스타민(His)는 극성이지만 분자 내부에 존재하여[[1]] 헴과 상호작용을 함
③ 헴의 구조
- 헴 구조는 평평하기에 단백질 내부에 있는 소수성 공간에 꼭 들어맞을 수 있음 -> 소수성 상호작용(hydrophobic attraction)에 의해서 내부에 잘 결합할 수 있음
- 헴(heme) 작용기 = 금속이온 Fe(Ⅱ) + 프로토포르피린 Ⅸ (protoporphyrin Ⅸ)
- 프로토포르필린과 Fe가 4개의 결합을 형성 (소수성 상호작용)

④ 헴과 히스티딘의 구조적 관계

ⅰ) 마이오글로빈은 산소를 흡/탈착 해서 근육 근처에 산소 등을 운반 및 저장할 수 있는 기능을 하는데, 이를 수행하는 구조가 헴 - 히스티딘 복합체
ⅱ) Fe의 남아있는 두 자리 중 한 공간에 F8 히스타딘이 결합하고 나머지 공간에 산소 및 일산화탄소가 연결될 수 있음
ⅲ) 나머지 H7 히스타딘은 프로토포르필린 고리 평면에 수직으로 존재하여, 산소 또는 일산화탄소와 헴 구조 사이의 결합각을 조정해서 기체가 마이오글로빈에 탈/부착되는 정도를 조정함
⑤ 헴 - 히스타딘 산소(일산화탄소) 탈/부착 세기 조정 메커니즘
- 일반적으로 일산화탄소의 헴 부착 정도가 산소에 비해 25,000배 더 강함
a) 더 잘 부착되는 일산화탄소가 E7 히스타딘의 방해 없이 헴 구조와 잘 결합을 유지하고 있음 -> 혈액 내 과도한 일산화탄소는 독극물로 작용하기에 중독을 유발하고, 뇌 손상으로 이어짐
b) His E7이 Heme 구조 위에 배치하기에 실제로는 결합각이 조정되어 일산화탄소가 헴 구조와 결합을 형성 -> 기존 보다 수백 배 결합력이 작아짐 -> 모든 헴 구조에 일산화탄소가 결합되지 않고 c)에서 보이는 것처럼 산소가 결합할 수 있는 가능성이 생겨 물질대사의 근거가 됨
c) 만약 산소가 헴 구조에 강하게 결합되어 있다면 흡착은 쉬워도 탈착이 어려울 수 있음 -> 마찬가지로 His E7이 산소와 헴 구조 사이의 결합력을 조정하여 흡착력을 약화하더라도 탈착도 더 잘 진행되도록 함 -> 산소가 더 잘 사용될 수 있도록 함
cf) 헴 구조가 단백질 내에 존재하지 않을 때 철이 산화한 형태로 존재할 수 있으며, 여기에는 산소가 붙을 수 없기에 단백질과 헴 구조 모두 존재해야 산소를 저장할 수 있는 기능을 비로소 실현함
4) 변성과 재접힘 (Denaturation and Refolding)
① 변성 (Denaturation)
- 3차원 구조를 유지하는 비공유성 상호작용의 세기가 약하기에 외부 조건에 의해서 쉽게 변화가 가능
- 단백질의 풀림을 변성이라고 말함
- 변성의 원인
ⅰ) 열(heat): 분자 내 진동을 촉진해 Interaction을 파괴
ⅱ) pH: pH의 조정으로 amino acid의 정전기적 상호작용(electrostatic interaction)에 변화가 생기고, 이는 분자 사이의 interaction에 영향을 줄 수 있음
ⅲ) 도데실 황산 나트륨 (Sodium Dodecyl Sulfate, SDS)의 결합: 세제는 소수성 상호작용을 파괴해서 분자의 구조에 변형을 줌
ⅳ) 특정 시약의 존재: 단백질과 강한 수소 결합을 형성하여 기존의 결함을 깨고, 변형을 줄 수 있음
e.g. 요소(urea), 구아니딘 염산염 (guanidine hydrochloride) emd
ⅴ) 이황화결합 (-S-S-)의 환원: -S-S- -> -SH로 환원함으로써 단백질 변성을 촉진함
② 재접힘 (refolding)
- 외부 조건의 자극을 조심스럽게 다시 돌려놓으면 변성된 단백질이 다시 회복될 수 있으며, 이때의 과정을 재접힘 과정이라 부름
- 이때에는 3차 단백질 결정 상호작용도 중요하지만, 1차 구조의 우위가 더 높음 (아미노산의 서열이 3차원 단백질의 정보를 갖고 있음)
- 머캅토에탄올과 요소를 제거하면 단백질의 변성이 다시 회복될 수 있음
- 하지만, refolding에 의해서 기존과 100% 동일하게 합성이 되는 것은 운에 맡겨야 하는 문제
cf) 유전공학에서 세포에 있는 유전 정보를 이용해서 복제를 진해할 수 있음. 이때, 세포는 dense하기 때문에 aggregation이 자연스럽게 발생할 수 있기에 Cell을 깨서 denaturation을 한 후 다시 refolding을 하는 경우가 있음 (이때도 마찬가지로 완벽한 refolding이 진행되는 것은 운에 맡겨야 함)
5. 단백질의 4차 구조 (Quaternary Structure of Proteins)
- 2개 이상의 폴리펩타이드 사슬로 구성된 단백질이며, 각각의 폴리펩타이드 사슬을 소단위체(subunit)이라고 함
e.g. 올리고머(oligomer): 2량체(dimer), 3량체(trimer), 4량체(tertramer)
- 기존의 단백질 구조와 마찬가지로 다양한 상호작용을 통해서 형성이 됨
- 알로스테릭(allosteric): 비공유성 상호작용으로 단백질의 한 부분이 미묘한 구조 변화가 발생하는데, 이 변화 때문에 다른 부분의 성질이 크게 변하는 것 (나비효과-like)
1) 헤모글로빈 (Hemoglobin)
- 맥스 퍼루츠와 존 캔드류가 처음으로 구조를 밝혀냈으며, 2번째로 구조가 밝혀진 단백질 (노벨상 수상, 1962)
- 혈액 속에서 단백질을 수송하는 역할을 함
① 구성
- 4개의 폴리 펩타이드 사슬[[1]] (2 alpha chain + 2 beta chain) + 헴 구조
② 외부 단백질 골격
- alpha chain의 정보는 16th 염색체에, beta chain의 정보는 11th 염색체에 암호화되어 있음
- 마이로글로빈의 알파 사슬과 베타 사슬과 매우 유사
- 헤모글로빈 알파 사슬: 151개 잔기 & 베타 사슬: 146개 잔기 cf) 헤모글로빈: 잔기 153개
③ 마이로글로빈과 헤모글로빈의 산소 저장 용량
- 마이로글로빈은 하나의 산소 분자를 저장할 수 있는 반면 헤모글로빈은 4개의 산소 분자를 저장할 수 있음 (4단량체이므로 각 사슬에 하나의 산소 분자를 저장할 수 있기 때문)
-> 산소 포화 정도는 마이로글로빈이 더 빨리 진행됨

- 헤모글로빈의 산소 결합은 양성적 협동성 (positive cooperativity)[[1]]를 보임
- 협동성 결합은 산소 결합의 경향성을 보이는 것이지 절대적 결합 정도를 보이는 것이 아님
i.e. 마이로글로빈은 산소에 대해 양성적 협동성을 보이지는 않지만, 임의의 산소압에서 항상 헤모글로빈보다 포화도가 높은 것을 확인할 수 있음
④ 헤모글로빈 작동 메커니즘
- 헤모글로빈은 산소를 운반하는 것을 주 기능으로 함
i.e. 산소와 단단히 결합할 수도 있어야 하지만, 때로는 산소를 쉽게 방출할 수 있어야 함
- 폐포(pO2=100)에서 헤모글로빈은 100% 포화되며 모세혈관(pO2=20)에서는 포화도가 50%보다 조금 낮음 -> 산소가 필요한 모세혈관에서는 헤모글로빈은 산소를 잘 내어놓음 -> 모세혈관에서 산소를 내어놓는 다는 것은 조직으로의 산소 전달이 용이함을 뜻함
⑤ 헤모글로빈의 기능에 수반되어 일어나는 입체 구조의 변화 (1): O2 흡착과 H+ 흡착 사이의 관계
ⅰ) 산소가 결합한 헤모글로빈(옥시헤모글로빈, oxyhemoglobin) vs 산소를 방출한 헤모글로빈(디옥시헤모글로빈, deoxyhemoglobin)
- 옥시헤모글로빈에서 beta 사슬의 거리가 디옥시헤모글로빈에서보다 더 가까움 (옥시헤모글로빈의 중앙 공간이 훨씬 좁음)

ⅱ) 옥시헤모글로빈과 디옥시헤모글로빈의 pKa와 acidity
- 디옥시헤모글로빈 pKa = 7.8 (상대적 염기성) -> 혈액(pH=7.4)에서 H+와 결합하려 함
- 옥시헤모글로빈 pKa = 6.7 (상대적 산성) -> 혈액(pH=7.4)에서 H+를 내어놓으려 함
=> 헤모글로빈에 대해 O2 흡착과 H+ 흡착은 반비례 관계를 보이는 것을 알 수 있음
e.g. 산소가 결합한 헤모글로빈은 수소 이온과 결합을 잘 유지하지 못함
=> H+ 농도의 증가는 헤모글로빈의 산소 친화력을 감소시킴 (i.e. 디옥시헤모글로빈이 H+와 결합을 해서 그 양을 감소시킴)
⑥ 헤모글로빈의 기능에 수반되어 일어나는 입체 구조의 변화 (2): CO2 흡착과 H+ 흡착 사이의 관계
- H+ 농도의 변화는 O2 뿐 아니라 CO2의 흡착 여부에도 영향을 미침: 보어 효과 (Bohr effect)
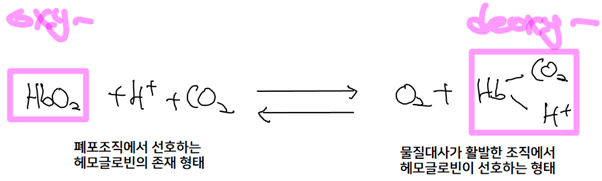
ⅰ) H+ 농도에 따른 CO2 조정 메커니즘
- @ 근육 조직, 젖산의 증가로 H+ 농도 증가 -> 헤모글로빈 산소 친화력 감소 (디옥시헤모글로빈의 양 증가) & 양성자의 결합 (알파 사슬의 N 말단 or 베타 사슬의 His146) -> (+) 전하를 띤 디옥시헤모글로빈은 Asp94와 염교를 형성하면서 안정화
(즉, 근육조직은 acid environment이기 때문에 여기에 과량으로 존재하는 수소 이온과 옥시헤모글로빈이 반응을 해서 디옥시헤모글로빈으로 전환됨)
=> system의 H+ 농도와 CO2 흡착 정도는 비례 (산성일수록 디옥시헤모글로빈으로 존재 경향 증가)
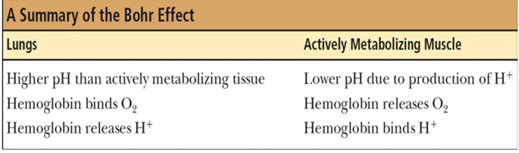

- pH가 낮은 system에 존재하는 헤모글로빈일수록 디옥시헤모글로빈 형태를 선호하기 때문에 산소 포화도 정도가 감소하며, 이를 위의 그래프에 요약함
ⅱ) CO2의 완충효과
- 헤모글로빈 사이의 전환으로 대사산물로 CO2가 형성되는 사실을 알 수 있음
a) 이산화탄소의 이온화에 의한 효과
- 혈액 내의 CO2는 탄산(H2CO3) 형태로 존재할 수 있음 (CH 2 호흡 메커니즘에서 언급)
- 이를 정량적으로 살펴보면 혈중 CO2의 약 90% 정도가 탄산으로 전환되어 존재 (HH equation)

i.e. CO2로부터 형성된 탄산의 90%가 이온화되는 것을 뜻하고, 이는 결국 CO2의 90%가 탄산이온의 형태로 존재하여 H+를 내어놓는데 기여하는 것을 뜻함
: 이때 내어놓은 H+가 옥시헤모글로빈을 디옥시헤모글로빈으로 전환하게 됨 (산소 포화도의 감소)
b) 이온화되지 않은 이산화탄소의 효과
- 이온화되지 않은 CO2는 헤모글로빈과 결합되어 운반될 수 있음
- 이산화탄소와 유리되어 있는 alpha amino acid와 결합을 해서 카밤산염(carbamate)을 생성

- 이 반응은 alpha 아미노 말단이 음이온으로 전환이 되며, 이는 디옥시헤모글로빈의 alpha 사슬에 있는 Arg141과 정전기적 상호작용을 일으켜 안정하게 존재할 수 있도록 함
=> CO2는 a)와 b) 메커니즘을 통해서 서로 다른 2가지 효과를 갖고 있음 (입체구조 전환 & 안정화)
=> 결과적으로 헤모글로빈의 산소 운송과 H+ CO2 사이의 관계성을 통해서 pH와 체내 산소/이산화탄소의 농도를 조정할 수 있게 됨
⑦ 헤모글로빈과 BPG(2,3 - BisPhosphoGlycerate) 사이의 상호작용
- BPG의 존재와 헤모글로빈 산소 수용 능력의 변화
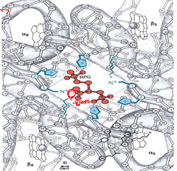
- BPG는 자체적으로 음전하를 갖고 있으며, 단백질이가 갖고 있는 양전하와 정전기적 상호작용을 일으켜 헤모글로빈의 입체 구조에 변형을 가져옴
- 산소가 결합해야 할 자자리에 BPG가 배치됨으로써 헤모글로빈의 상대적인 산소 수용 능력이 감소하여 더 적은 산소 분압에서도 헤모글로빈이 포화될 수 있음
i.e. BPG가 없다면 모세혈관(pO2=20)에서도 헤모글로빈이 거의 포화된 상태로 존재할 수 있기 때문에 조직으로 산소를 잘 전달하지 못하게 됨
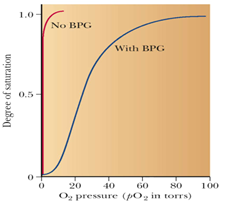
⑧ 태아의 산소 수용 능력
- 태아의 해모글로빈 (HbF, α2γ2)은 성인의 헤모글로빈 (HbA, α2β2) 보다 산소를 잘 수용할 수 있음

- 이유
ⅰ) 서로 다른 2가지 폴리펩타이드 사슬이 존재
- 성인의 헤모글로빈 α2β2 vs 태아의 헤모글로빈 α2γ2
ⅱ) Hb F가 Hb A보다 BPG와 덜 강하게 결합을 함
- beta 사슬의 His143(Basic)가 BPG와 상호작용 형성
- gamma 사슬은 His143이 Ser143(Neutral)로 바뀌어 BPG와 상호작용을 형성
-> 전기적으로 중성이 상호작용에 관여하게 되므로 BPG와 결합정도가 감소할 수밖에 없음
-> BPG가 더 적게 결합되어 있으면, 그 자리를 산소가 차지할 수 있게 되므로 작은 분압에서도 포화가 잘 일어남 (태아 헤모글로빈의 산소 포화도 상승)
6. 단백질 접힘의 역학 (Protein Folding Dynamic)
1) 생물정보학 (Bioinformatics)
- 생화학에서 많은 양의 정보를 처리하기 위해 컴퓨터 방식을 이용하는 것
- 이를 이용해서 단백질 구조를 예측할 수 있음
cf) 핵산의 정보를 연구할 수도 있으며, 결국 핵산으로부터 정보 전달이 시작되기에 중요함
2) 단백질 구조의 예측 알고리즘
- 상동성(homology): 두가지 아미노산 서열 사이의 유사성을 말하며, 단량체의 순서가 유사하면 해당 아미노산은 서로 상동성을 갖는다고 말할 수 있음

- 드노브 예측법: 기존의 데이터베이스와 비교하지 않고 처음부터 독자적으로 구조를 예측
- Database들은 공식 인터넷 사이트 등에 잘 제시되어 있음
3) 소수성 상호작용: 열역학에서의 사례 연구 (Hydrophobic Interactions: A Case Study in Thermodynamics)
- 소수성 상호작용은 긴 분자배열을 갖는 단백질들이 분자 구조를 결정하는데 중요한 영향을 갖고 있음
① 인지질 이중막
- 인지질: 양친매성 분자 -> 수용액에 인지질에 들어가면 친수성 부분으로 표면이 형성되며, 소수성 부분이 내부로 배향되어 이중막 구조를 형성함
-> 리포솜(liposome)이라는 3차원 구조를 형성함: 이 구조는 약물 전달에 중요하게 사용되는 구조
- 이중막에 있는 단백질도 소수성 부분에 포함되어 있기 때문에 소수성 상호작용의 일례
② 사이토크롬 C 단백질의 3차원 구조
- 소수성 상호작용은 단백질 내부를 향하여, 배치되고, 친수성 상호작용은 단백질 외부를 향하여 배치됨
③ 소수성 상호작용이 잘 발생하도록 하는 요인
- 소수성 상호작용은 자발적이며, 이 상호작용이 발생할 때 우주의 엔트로피는 증가함
e.g. 헥세인과 물의 혼합: 잘 발생하지 않음
- 비극성 용매인 헥세인을 둘러싸고 있는 물은 서로 수소작용을 할 수 있는데, 비극성용매를 둘러싸면 물끼리 수소 결합을 해서 엔트로피가 감소하게 됨
- 만약에 용해가 잘 되면 지나치게 엔트로피 감소폭이 커지게 되어 열역학 제 2법칙에 반하고, 실제로 잘 진행되지 않음 (오히려 비극성 용매의 상호작용으로 비극성 용매와 극성 용매끼리 분리됨)
e.g. 아미노산의 소수성 상호작용
- 아미노산끼리 상호작용을 하는 것을 우선으로 생각하지만, 엔트로피의 감소를 막기 위해서 물이 아미노산을 수화하지 않아 밀려난 아미노산이 결합을 하는 것으로 생각하면 더 편함
4) 올바른 접힘의 중요성
- 세포 내부는 protein-dense environment이기 때문에 단백질이 올바르게 생성되지 못하고 과도하게 뭉치는 경우가 있음 (aggregation)
- aggregation 형태의 단백질은 올바르게 접힐 수 있는 단백질도 aggregative하게 만들어버림

a) 부분적으로 접혀 있는 단백질은 정상적인 환경에서는 적당히 상호작용을 해서 올바르게 접힐 수 있음
b) dense한 상황에서는 aggregation이 발생할 수 있으며, 이는 다른 단백질과 상호작용을 해서 단백질 침전을 일으킴
e.g. 신경퇴행성 질병 (알츠하이머, 파킨슨, 헌팅턴, 프라이온 질병)
5) 단백질 - 접힘 샤프론
- 생체 내에서 단백질이 올바르고 적절한 시기에 접촉이 되도록 도움 (모든 생물체 내부에 존재)
e.g. 잘못된 단백질과 상호작용을 하지 못하도록 or 부적절한 방향으로 단백질이 형성되는 것을 방지
- 샤프론의 예: hsp70[[1]] (heat-shock protein)

- alpha 사슬과 beta 사슬은 각각 16th, 11th 염색체에 암호화되어 있기 때문에 발현 조절이 복잡함
- alpha 사슬 2개당 beta 사슬 하나가 존재하기 때문에 항상 alpha 사슬이 과량으로 존재함
-> 이는 단백질의 aggregation이 형성될 수 있는 조건
- If aggregation이 제거되지 못하면 alpha 사슬의 침전이 진행되며, 적혈구가 운반할 수 있는 산소의 양이 감소한 것을 의미함
-> 이를 지중해성 빈혈(thalassemia)라고 함
- 이를 방지하기 위해서 alpha 헤모글로빈 안정화 단백질 (AHSP)가 alpha 사슬끼리 침전이 안되도록 조절해주어 정상적인 헤모글로빈 생성을 도움 (or beta 사슬로 alpha 사슬을 전달)
7. 프라이온 (Prion): 2차 단백질 접합의 중요성
1) 프라이온 개념
- 스탠리 프루지너가 처음 발견해 1997년 노벨의학상 수상
① 신경조직의 세포막에서 발견되는 크기가 작은 천연 당단백질 (조혈 줄기세포의 세포막에서도 발견)
② 프라이온의 정상 구조와 돌연변이 구조
ⅰ) 정상구조 (PrP)
- alpha helix rich: 한 번의 회전에 210개의 아미노산이 있음
- 23,100g/mol amino acid + 11,000g/mol 당지질
ⅱ) 비정상구조 (PrPSC)
- 정상구조와 분자량, 구성이 모두 동일하나 alpha helix가 beta sheet 구조로 변함
- 인접한 정상 단백질까지 변형을 시켜서 장애를 유발
2) 광우병 (TSE, Transition Spongiform Encephalopathy)
- 프라이온의 변형으로 생기는 대표적인 질환 중 하나
- 뇌 섬유화가 진행되어 신경세포들이 퇴화하기 때문에 개체가 미쳐가고 결국 죽게 되는 질환
① 광우병의 분류: 개체마다 명명이 조금 다름
- 소 (BSE, Bovine Spongiform Encephalopathy)
- 사슴/엘크 (CWD, Chronic Wasting Disease)
- 양 (Scrapie)
- 사람 (vCJD, Creutzfeldt)
② 발현 매커니즘
- 구체적으로 발현 매커니즘이 규명되어 있지 않지만, 프라이온 질환은 유전적이며 감염 인자에 의해 전파가 가능하기에 뇌에 critical한 영향을 미침
③ 문제점
- 프라이온은 살아있는 개체에 대해 측정하는 것이 매우 어렵기 때문에 증상을 보고 광우병이라고 유추하는 것
- 백신도 따로 없으며, 실제로 예방하기도 불가능
④ 검사방법
- 살아있는 개체에 대해 검사를 진행하는 것이 매우 힘듦
e.g. 뇌 조직을 추출해서 측정하는 것이 대표적이나 생(生)물의 뇌조직 추출에는 어려움 ㅇㅆ음
e.g. 광우병에 걸린 사람의 혈액을 측정해보니까 비정상 프라이온 PrPSC의 분자 개수가 103~104개 이며 이를 농도로 바꿔 표현하면 10-18정도 -> 매우 낮은 농도이기 때문에 측정에 어려움이 분명히 있으며 microscopic scale의 신호를 잘 감지할 수 있는 biosensor의 제작이 요구됨
- 그럼에도 불구하고 측정을 한다면, 기본적으로는 ELISA (Enzyme Linked Immuno Sorbent Assay) 방법을 이용함 (~pM)
'전공 개념.zip > 생화학' 카테고리의 다른 글
| CH6-2 효소-기질 결합 (0) | 2020.11.26 |
|---|---|
| CH 6-1 효소 반응속도론 대 열역학 (0) | 2020.11.26 |
| CH 3 아미노산과 펩타이드 (Amino Acid and Peptides) (1) | 2020.10.29 |
| CH 2 물: 생화학 반응의 용매 (0) | 2020.10.29 |
| CH 1 생화학과 세포의 구성 (0) | 2020.10.28 |