
Ⅰ. Title
유기합성 (Grignard Reaction)
Ⅱ. Purpose
1. Grignard 시약을 제조하고, 이를 Ketone과 반응시켜 Alcohol을 합성한다.
2. 생성된 물질을 적외선 분광법 (Infrared Spectroscopy)을 통해 잘 이루어졌는지 확인한다.
Ⅲ. Theory
1. 친핵체와 친전자체의 분류
1) 유기반응과 전자의 이동
유기 반응은 여러 반응물의 결합 사이의 전자 이동을 바탕으로 진행된다. sigma bond는 원자핵사이에 있기에 편재성이 강해 이동하지 못하기에, 유기 반응에서는 특히 pi bond에 있는 전자의 이동에 의해 진행된다. 전자는 홀로 공여될 수 없기에, 반응물들 사이에서 어떠한 물질이 전자를 주고, 어떠한 물질이 전자를 받는지를 아는 것이 중요하다.
2) 친핵체와 친전자체
① 친핵체(nucleophile, Nu)
화학결합을 형성할 때 전자쌍을 주는 물질들을 친핵체로 분류한다. 대표적으로 pi 결합을 형성하는 물질 또는 비공유전자쌍을 갖고 있는 물질들을 말한다. 이러한 특성 때문에 친핵체는 루이스 염기에 해당한다.
② 친전자체(electrophile)
친핵체와 반대로 화학결합 형성 시 전자쌍을 받는 물질을 친전자체라고 한다. 붕소처럼 축소된 옥텟을 갖고 있거나 상대적으로 양전하를 띠고 있는 물질들을 예로 든다. 전자를 받는 물질이기에 친전자체는 루이스 산을 말한다.
친핵체와 친전자체는 절대적이지 않으며, 각 반응 조건에서 반응물의 acidity 등을 고려하여 판단해야 한다.
2. 친핵성 첨가반응과 친전자성 첨가반응
유기 반응은 크게 첨가, 치환, 제거반응이 있다. 그 중에서 친핵체와 친전자체를 중요하게 언급하는 반응은 첨가반응(Addition Reaction)이기에, 이를 간단히 살펴보자. 첨가반응은 Markovnikov 규칙을 따르도록 진행되거나, 때에 따라서는 이에 반하는 반응 메커니즘을 갖는다. 그 중에서도 이번 실험에서 직접적으로 사용되는 친핵성 첨가반응에 대해 설명하겠다. 탄소 C에 전기음성도가 큰 O와 N이 연결되면 상대적으로 탄소가 (+) 전하를 띨 수 있다. 유기 반응 시 이 탄소는 친핵체로부터 공격을 받아 sigma bond를 형성할 수 있다. 이 반응을 친핵성 첨가반응이라고 한다. 친핵성 첨가반응은 C=O, C=N과 같은 결합을 갖고 있는 물질에서 잘 관찰되며 그 예로는 알데하이드와 케톤이 있다.
3. Grignard reagent의 제법과 Grignard Reaction
1) Girgnard reagent
다중결합이 포함되어 있는 탄소에 대해서 새로운 탄소를 결합하는 것은 크게 어렵지 않다. 반면 탄소 사이에 sigma 결합만 존재한다면, 새로운 탄소를 결합하는 데에는 어려움이 존재한다. 이는 유기급속 화합물을 이용해서 해결할 수 있다. 유기 금속 화합물은 Organolithium(R-Li), Grignard Reagent(R-MgBr), 그리고 Gilman Reagent(R-Cu + R-Li)가 있다. 그 중에서도 Grignard Reagent는 좋은 친핵성을 보이기에 많이 사용된다. Grignard Reagent는 알킬 할라이드를 이용해서 합성할 수 있다. (여기서 말하는 할라이드는 F를 제외한 17족 원소 Cl, Br, I를 말한다.) Grignard Reagent는 강한 염기성을 보이며(강한 친핵체) 그렇기에 산-염기 반응이 쉽게 진행된다.
2) Grignard Reaction
① reaction에서 사용하는 용매
Grignard Reagent가 system에 포함된, 즉 Grignard Reagent를 합성하거나, Grignard Reagent를 이용해서 친핵성 반응을 진행하거나 모두 용매를 물로 사용하면 안된다. 산-염기 반응에 의해서 원하지 않던 물질이 생성되기 때문이다. 대표적으로 사용하는 용매는 ether이며, diethyl ether와 THF 등이 있다. 뿐만 아니라 ether는 Grignard Reagent를 안정하게 만들 수 있기에 사용된다. ether 가운데에 있는 산소의 비공유전자쌍이 마그네슘과 결합해서 배위화합물을 형성할 수 있기 때문이다.
② Grignard Reaction
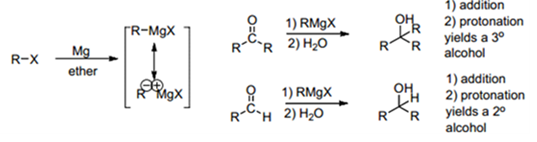
Grignard reaction은 염기성 상황에서 진행되는 대표적인 친핵성 첨가반응 중 하나다. 친핵체는 Grignard Reagent에 연결되어 있는 알킬기인 탄소음이(Carbanion)이며, 상대적으로 (+) 전하를 띠는 카르보닐기에 연결된 탄소 C를 공격한다. 반응 도중 알콕시화 마그네슘 중간체가 형성된다.

Ether 용매 조건 하에서 알데하이드랑 반응하면 2차 알코올을 형성할 수 있으며 ketone과 반응을 하면 3차 알코올을 형성할 수 있다.
4. IR Spectroscopy
1) 분자의 에너지와 IR Spectroscopy의 개념
분자의 에너지는 양자화되어 있으며, 전자에너지 준위, 진동에너지 준위, 회전에너지 준위의 합으로 구성된다. 전자에너지 준위가 가장 크며, 회전에너지 준위가 가장 낮다. IR Spectroscopy(이하 IR)는 적외선을 광원으로 삼아 미지 시료의 정보를 추론하는 분광 분석법이다. 적외선 영역의 빛의 에너지는 크기 않기에 분자 결합의 진동에너지에만 영향을 줄 수 있다. 즉 IR을 통해서 분자 결합의 에너지 측정을 목표로 하고, 분자 결합의 종류는 peak가 나타나는 에너지의 범위를 통해 추론한다.

2) 측정원리 및 해석방법
IR에서 적외선의 경로는 광원 -> 간섭계 -> 시료 -> 검출기를 따른다. 이때 첫 측정은 Background로만 진행으로 하며, 두 번째에는 미지 시료와 Background(KBr 등)의 혼합물을 시료로 삼아 분석을 한다. 두 실험 결과에 나타난 파장에 대해 Sample / Background의 비율을 IR의 실험 결과로 얻으며, 여기서 나타나는 peak가 속한 에너지 범위와 reference를 비교하여 시료가 갖고 있는 결합을 추론한다. 이를 통해 IR은 분석의 범위가 한정적이기 때문에 정보를 어느 정도 알고 있는 시료에 대해 분석하는 것이 유리한 것을 알 수 있다. 예를 들어 정제 과정 후 목표한 물질을 잘 분리했는지, 순물질에 대해 어느 정도 물질이 벗어났는지를 확인하는 데 유리하다. 이번 실험을 통해 얻은 물질은 Triphenyl Methanol이며, 해당 물질의 분자구조와 IR 스펙트럼은 아래와 같다.

Ⅳ. Chemicals & Apparatus
1. Chemicals
|
물질 이름 |
화학식 |
화학식량(g/mol) |
밀도(g/mL) |
녹는점(℃) |
끓는점(℃) |
|
Bromobenzene |
C6H5Br |
157.010 |
1.495 |
-30.8 |
156 |
|
Magnesium |
Mg |
24.305 |
1.738 |
650 |
1091 |
|
Anhydrous diethyl Ether |
(C2H5)2O |
74.123 |
0.7134 |
-116.3 |
34.6 |
|
Benzophenone |
(C6H5)2CO |
182.222 |
1.11 |
48.5 |
305.4 |
|
Sodium Chloride |
NaCl |
58.43 |
2.71 |
800.7 |
1465 |
|
Ammonium Chloride |
NH4Cl |
53.49 |
1.519 |
|
|
|
2-Propanol (isopropyl alcohol) |
(CH3)2CHOH |
60.096 |
0.786 |
-89 |
82.6 |
|
hexane |
C6H14 |
86.178 |
0.6606 |
-96 ~ -94 |
68.5~69.1 |
|
triphenyl methanol (product) |
(C6H5)3CHOH |
260.33 |
1.199 |
160 ~ 163 |
360 ~ 380 |
2. Apparatus
syringe(주사기), septa, vial(공병), reflux condenser, N2 balloon, dropping funnel(분액 깔때기), beaker, torch, FT-IR, 3-neck round bottom flask(3-neck RB), stirring bar, rotary evaporator, aspirator
Ⅴ. Procedure
1. Grignard reagent (Phenylmagnesium Bromide) 제조
1) 3-neck RB에 마그네슘 200mg과 stirring bar를 넣은 뒤, septa로 밀봉하여 reflux condenser에 clip을 사용하여 연결한다.
2) torch로 flame drying을 진행하고 잠시 상온에서 식힌다.
3) syringe로 anhydrous diethyl ether 3mL를 넣고 10분 이상 stirring한다. (에테르를 뽐을 시 질소 purging법을 따라 진행한다.)
4) 이어서 syringe를 이용하여 dried bromobenzene 0.9mL와 anhydrous diethyl ether 3mL를 순서대로 천천히 3-neck RB에 넣어준다.
5) 미지근한 물을 비커에 담아 RB에 열을 전달한다.
6) 발열반응이 진행되며 자연적으로 ehter가 reflux가 된다. (약 1시간 정도 소요)
2. Triphenyl methanol 제조
1) 1에서 만든 Grignard reagent를 식힌다.
2) Benzophenone 1.5g을 ether 3mL에 녹여서 3-neck RB에 넣어준다.
3) 찬 물로 RB를 식히고 saturated ammonium chloride solution (실험실에 비치된 것은 가루(염)형태이므로 Solubility를 확인하여 수돗물로 제조 후 사용
4) Ether(non-hydrous, solvent용)를 더 넣은 후 solid(creamy-white)가 사라질 때까지 흔들어준다.
5) Dropping funnel에 생산물을 옮겨 담고 물 층을 제거한 뒤, NaCl 용액으로 씻어준다.
6) 다시 물 층을 분리한 후 anhydrous magnesium sulfate(고체)를 넣어 drying한다.
7) 거름종이를 활용하여 drying agent를 제거하고 Rotary evaporator를 이용해 Ehter를 날린다.
8) Hexane 10mL를 넣고 재결정시킨다. (잘 되지 않으면 2-propanol을 소량 넣어준다.)
9) 재결정을 통해 얻은 수득물을 하루정도 말려준다.
3. FT-IR 분석
1) 시료와 KBr을 1:1 비율로 섞은 후, 막자사볼로 간다. (실험 결과가 잘 안 나오면 KBr의 비율을 늘린다.)
2) Disc kit에 시료를 고르게 담는다. 이때 벌어지는 공간은 종이 등으로 채워준다.
3) 가압프레스로 압축하여 투명한 디스크를 만든다.
4) FT-IR 기기를 작동시키고, 컴퓨터에서 OMNIC 프로그램을 켠다.
5) 투과모드로 Background를 먼저 찍고, 시료 홀더에 디스크를 고정시켜 IR 스펙트럼을 얻어낸다.
Ⅵ. Data & Result
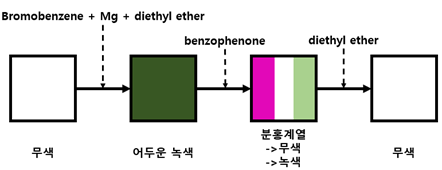
1. 시약의 색 변화
유기 합성 과정에서 반응 단계에 따라서 색 변화가 나타났으며, 구체적으로는 아래와 같았다.
2. IR spectrum 관찰 결과
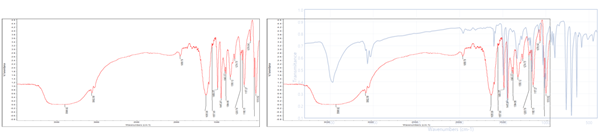
1) IR에서 관찰된 시료의 peak와 해당 peak에 대응하는 원자사이의 결합은 아래와 같다.
|
peak wavenumber (cm-1) |
possible bond |
peak wavenumber (cm-1) |
possible bond |
|
3398.92 |
-OH (alcohol, inter) |
1384.66 |
-OH (phenol) |
|
3062.58 |
-OH (alcohol, intra) |
1330.12 |
C-O (alkyl aryl ether) |
|
1958.79 |
-CH (aromatic) |
1274.73 |
C-O (aromatic ether) |
|
1635.09 |
C=C (cyclic alkane) |
1203.79 |
C-O (ester) |
|
1577.93 |
C=C (cyclic alkane) |
118.015 |
C-O (tertiary alcohol) |
|
1489.37 |
∙ |
1157.27 |
C-O (tertiary alcohol) |
|
1445.24 |
-OH (alcohol) |
1078.54 |
C-O (primary alcohol) |
|
1397.77 |
-OH (alcohol/phenol) |
1010.62 |
∙ |
2) Reference Data와 비교해봤을 때 다른 wavenumber에 대해서는 거의 동일한 경향성을 보이지만, 1397.77과 1384.66지점은 reference에는 나타나지 않은 peak임을 알 수 있다. 그렇기에 우리가 얻은 시료는 순수한 triphenylmethanol이 아니라 다른 물질이 혼합되어 있음을 알 수 있다.
Ⅶ. Discussion
이번 실험은 Grignard Reagent를 이용해서 Triphenylmethanol을 합성하고, 이를 IR을 이용해서 잘 합성되었는지 확인하는 것을 목표로 한다. 알려져 있는 유기물을 합성하려면 반응 메커니즘 등을 고려해서 실험환경을 잘 조성하는 것이 중요하다.
1. Triphenylmethanol synthesis의 정성적 해석
위의 메커니즘을 살펴보면서 이번 실험이 어떻게 진행되었는지, 주의할 점은 무엇이었으며 이를 최대한 어떻게 해결하려 했는지를 살펴보자. 이번 실험은 크게 2가지 반응단계를 거친다. 첫 단계인 Grignard reagent synthesis 과정에 대해서 살펴보자.
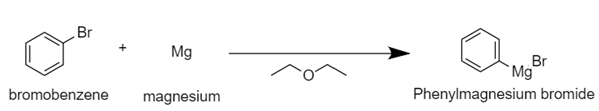
위에서 제시한 반응이 잘 진행된다면 좋겠지만, 발생할 수 있는 문제점들이 존재한다. 이는 대개 만들어진 Grignard reagent가 매우 강한 base이기 때문에 높은 반응성을 보이는 것으로부터 기인한다. 첫 번째로는 산-염기 반응의 진행에 따라서 girgnard reagent가 추가적인 반응을 보일 수 있다. girnard reagent보다 상대적으로 acidic한, 대표적으로 물, phenol derivatives, -SH, -NH 등과 반응을 할 수 있다. 이번 실험의 경우에는 기기 중의 수분, 공기 중의 수분 등이 synthesis 과정에 개입을 할 수 있으며, 이 반응은 벤젠과 MgBr(OH)를 생성한다. 이를 요약해서 아래에 나타냈다.

MgBr(OH)는 ether에 대해 낮은 용해도를 보인다. 그렇기에 반응이 진행되는 Mg의 표면 근처에서 앙금의 형태로 남을 수 있다. 이는 Mg와 Bromobenzene의 접촉 빈도를 낮추어 기대하던 것보다 Grignard reagent가 덜 생성될 수 있다. 이를 예방하기 위해서 이번 실험에서 flame drying을 진행해서 기기 안에 남아있는 수분을 최대한 제거하고 anhydrous diethyl ether와 dried bromobenzene을 사용해서 반응에 수분이 개입되지 않도록 했다. 두 번째로는 girnard reagent가 생성되면, 미처 반응하지 못한 반응물 bromobenzene과 반응을 추가적으로 진행하여 byproduct인 biphenyl을 형성할 수 있으며 이 반응을 요약해서 아래에 표현하였다.
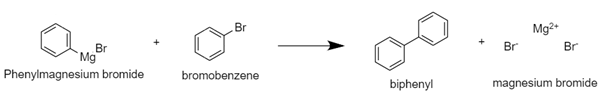
이는 준비했던 reactant가 원하는 생성물이 아닌 부산물이 생성되도록 함으로써 기대했던 양보다 grignard reagent가 더 적게 생성되도록 한다. 이 추가 반응은 system의 온도가 충분히 높거나 bromobenzene의 유입 속도가 너무 빠름 등 반응 속도가 빨라질 때 생길 수 있는 문제점이다. 이를 예방하기 위해서 bromobenzene을 dropwise하게 system에 유입하도록 해야 하고, 이를 위해서 N2 balloon을 사용했다. 문제점들을 잘 고려해서 반응을 진행했다면 반응이 진행되고 있는 혼합물 용액의 색이 변하는 것을 관찰할 수 있다. 직접 실행을 진행하지 않아 정확한 색을 구분할 수는 없었으나, 무색에서 어두운 녹색 계열로 이동한 것을 알 수 있다. 유기물의 색 변화는 mixture의 conjugation bond의 정도가 달라짐에 따라 변하며, 용액의 색이 변한 것을 통해서 물질 사이의 전환이 잘 발생했음을 확인할 수 있었다. 또한 실험을 직접 진행하지 않아 뚜렷한 관찰은 할 수 없었지만, 해당 반응이 잘 진행되었다면 system이 boiling하는 것을 확인할 수 있다. 이는 Grignard reagent synthesis가 발열반응이기에 열을 방출하기 때문이며, 이 열이 용매로 전달되었기에 발생하는 현상이다. 실제로 boiling으로 지나치게 ether가 기화되는 것을 방지하기 위해서 reflux condenser를 설치했다.
두 번째 단계로, 우리가 실제 목적으로 했던 Triphenylmethanol synthesis에 대해 생각해보자. 이 반응은 girgnard reagent를 이용한 친핵성 첨가반응 과정을 거쳐 진행된다. 친핵성 첨가반응 메커니즘을 거쳐 진행되는 반응을 요약하여 아래에 표현했다.

ketone인 benzophenone에서 상대적으로 음전하를 띠는 carbon에 Grignard reagent에서 electron이 상대적으로 rich한 phenyl이 공격을 하면서 triphenylmethanolate가 형성된다. 이는 우리가 얻으려고 했던 생성물의 음이온 형태로, 목표했던 생성물을 얻으려면 여기에 추가적으로 protonation 과정이 필요하다. 이를 위해서 포화 NH4Cl 수용액을 사용한다. 이 수용액은 NH4+가 상대적으로 산성을 보이는 특성을 이용한다. NH4+ -> NH3 + H+ 반응이 발생할 수 있으며, 여기서 나온 H+으로 triphenylmethanolate를 protonation을 하면 triphenylmethanol을 얻을 수 있으며, 이를 요약하면 아래와 같다.
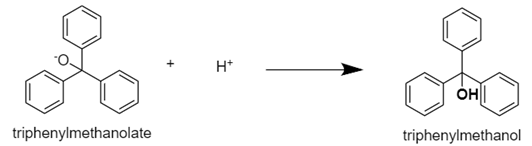
이 과정은 acid-base reaction이기 때문에 반응이 비교적 잘 진행된다. 한편, 포화용액을 사용하는 것은 이온 - 물 사이의 상호작용을 최대로 하여 물이 girgnard reagent 등 system에 미치는 영향을 최소화하기 위함이다. 위의 반응을 거치면서 마찬가지로 용액의 색이 변하는 것을 관찰할 수 있다. 최종적으로 진행된 반응의 %수율은 100%가 아니다. 이상적으로 반응이 진행되었을 때 첫 번째 단계에서 2개의 elementary reaction을 가지며 각각의 수율은 70%이며, 두 번째 단계에서 nucleophilic reaction과 acid-base reaction의 수율도 마찬가지로 70%다. 즉, 전체 반응의 수율은 약 24%정도이다. 정량적 수치에 대한 해석은 추후에 하도록 하며, 지금은 수율이 100%가 아닌 사실에 대한 의미를 살펴보자. 수율이 100%가 아니라는 것은 해당 system에 우리가 원했던 main product인 triphenylmethanol과 반응에 참여하지 못한 반응물들이 혼합된 형태일 것이다. 최대한 정제된 물질을 얻기 위해서 main product의 손실을 감수하고 재결정을 진행했다. 현재 혼합물에서 용매로 작용하는 물질은 물과 ether이다. triphenylmethanol은 alcohol이지만 phenyl의 steric effect로 인하여 ether에서 더 잘 용해된다. (다만, 물에 의한 용해효과가 미미하지만 발생하긴 한다.) 그렇기에 물의 밀도가 더 큰 사실을 이용해서 물을 먼저 분리해낸다. 그 다음으로는 불순물을 제거하기 위해서 반응성이 낮은 이온을 포함한 NaCl 수용액을 이용해서 다시 세척을 진행하고 물을 제거한다. 마지막으로 물과 alcohol의 -OH의 상호작용 등으로 ether 속에 포함되어 있는 물을 제거하기 위해서 drying agent로 사용되는 anhydrous MgSO4를 이용하고 filtering을 통해 제거한다. (필요에 의하면 drying agent의 전, 후 질량을 측정해서 ether에 포함되어 있던 수분의 양을 측정할 수도 있다.) 마지막으로 바로 evaporator를 이용해서 crude triphenylmethanol을 얻을 수 있으며 경우에 따라 hexane을 이용해서 보다 정제된 triphenylmethanol을 얻을 수 있다. 마지막으로 얻어낸 triphenylmethanol이 실제로 맞는지를 확인하기 위해서 IR spectrum을 측정했다. reference table에 비해서 실제 spectrum이 아래로 shift된 것을 보아 상대적으로 분자사이의 결합이 강하게 나타났음을 생각해볼 수 있다. 1397.77과 1384.66지점은 reference에는 나타나지 않은 peak가 발견되었으며, reference table을 따르면 해당 지점은 phenol류로 판단이 된다. 이번 반응 메커니즘에서 phenol이 합성될 수 있는 반응은 보이지는 않으나, 우연에 의해 진행이 되었을 수도 있으며 측정이 잘못되었을 수도 있다. 이처럼 IR 분석이 갖고 있는 한계가 있기 때문에 최근에는 NMR 기법 등을 이용해서 보다 정밀한 분석을 진행할 수 있다.
3. Triphenylmethanol synthesis의 정량적 해석과 impurity
산업측면에서 stochiometric relationship은 매우 중요하다. 그 이유는 크게 2가지이다. 첫 번째로, 준비한 반응물에 대해 얻고자 하는 생성물이 어느 정도 생성되었는 지를 추측할 수 있다. 두 번째로는 필요한 생성물의 양이 있을 때 반응물이 어느정도 필요한지를 역으로 계산해낼 수 있다. 이번 실험을 예로 들면 최종 생성물인 Triphenylmethanol을 합성하기 위해서 필요한 마그네슘, bromobenzene, benzophenone, diethyl ether의 양을 추측할 수 있다. 이번 실험은 유기 합성을 ‘진행’하는 것을 목표로 하기 때문에 준비된 반응물에 대해서 이론적으로 어느 정도의 triphenylmethanol이 생성될 것인지를 살펴보자. grignard reagent synthesis와 triphenylmethanol synthesis에서 관찰되는 반응계수는 모두 1:1로 동일하기에 이를 이용해서 계산을 진행하였다.
1) Grignard reagent synthesis
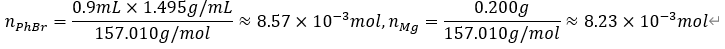
reaction Ph + MgBr -> Ph-MgBr은 실제로 2단계의 반응 메커니즘을 가지며, 구체적인 정량적 해석을 위해서 살펴보자. 각 단계에서 반응한 정도는 rate of extend ξ로 표기했다.


2) Triphenylmethanol Synthesis



즉 정상적으로 합성이 진행되었다면 이번 실험을 통해 얻은 Triphenylmethanol의 질량은 0.513g이여야 한다. 실험 과정에 포함되어 있지는 않았지만 얻은 물질의 purity를 아는 것도 중요하다. IR spectrum의 경우 impurity를 측정하기에는 어려움이 있기에 대표적인 impurity 측정 방법에 대해 소개하려 한다. 가장 보편적인 방법은 시료의 질량과 이론상 생성된 질량의 비율을 구하는 것이다. 반응의 불충분 진행, 물질의 손실, 불순물 포함 등으로 인해서 질량이 다르게 측정되는 경우가 많으며, 둘의 오차율을 구하는 방법이다. 또 다른 방법으로는 TLC 크로마토그래피를 이용한 측정 방법이 있다. 크로마토그래피를 이용한 정제 방법은 이동상의 종류에 대한 물질의 이동 정도가 잘 알려져 있다. 그렇기에 이를 reference로 삼아 실제 얻은 product의 이동 정도와 비교하여 오차율을 구하면 impurity를 알 수 있다.
4. Triphenylmethanol synthesis의 개선
특정 유기 화합물의 합성 메커니즘이 발견되었다면, 이를 개선하는 것도 중요하다. ‘개선’의 범위는 매우 넓으며, 반응 속도가 빨라지는 것 등이 포함된다. 이번에 synthesis를 어떻게 하면 더 잘 진행되도록 할 수 있는지 생각해보자. 우선 Mg를 활성화하는 것을 한 예로 들 수 있다. Grignard reagent 합성 과정에서 Mg가 반응을 위해 활성화되기 위해서 오랜 시간이 필요하다. Mg를 grinding하거나 스크래치를 낸다면 접촉면이 늘어나서 반응이 더 잘 진행될 수 있다. 또한 Grignard reagent 합성 진행 전에 iodine chip을 같이 넣어 반응을 진행하면 반응이 더 잘 진행된다. 또한 반응물을 바꿈으로써 반응 정도 변화에 영향을 줄 수 있다. 이번 실험에서 사용하는 benzophenone에 포함되어 있는 phenyl기는 1,3축 상호작용으로 측정하는 A-value의 값이 3.0 정도로 꽤 큰 편이며 첨가하는 탄화수소도 Phenyl이기 때문에 합성 시 불리할 수 있다. 그렇기에 초기 반응물을 benzophenone이 아닌 methyl benzoate를 사용하는 방법이 있다. metyl의 A-value는 0.7 정도로 phenyl에 비하면 매우 작기에 gridnard reagent가 더 잘 접근할 수 있으며, 이 물질을 이용한 반응 메커니즘을 요약하면 아래와 같다.

Ⅷ. Reference
1. Tangjie Zhang, The grignard synthesis of triphenylmethanol, Organic Chemistry, 2015, 288-292
2. Timothy S. Eckert, An Improved preparation of a Grignard reagent, Journal of Chemical Education 1987 64 (2), 179, DOI: 10.1021/ed064p179
'자료.zip > 화공생명공학전공실험' 카테고리의 다른 글
| PCR + 전기영동 (0) | 2021.02.01 |
|---|---|
| FT-IR 분석 실험 (0) | 2021.02.01 |
| 접촉각 측정 (Contact Angle) (1) | 2020.12.17 |
| 증기압측정 (0) | 2020.09.26 |
| Differential Scanning Calorimeter (DSC) pre report (1) | 2020.09.01 |