
Ⅰ. Title
증기압 측정
Ⅱ. Purpose
1. 증기압과 동적 평형 상태에 대해서 이해한다.
2. 상평형 그림에 대해서 이해하고, 그 중에서도 증기압곡선에 대한 지식을 습득하여 압력과 끓는 점 사이의 관계를 이해한다.
3. 온도에 따른 증기압 변화를 나타내는 식인 Clausius-Clapeyron 식을 유도해본다.
4. 실험을 통해 그래프를 plot하여 물이 증발할 때의 엔탈피 변화를 구해본다.
Ⅲ. Theory
1. 동적평형 (dynamic equilibrium)
가열 등 특정 물질에 변화를 가할 때 거시적으로 물질에서의 변화가 관찰되지 않는 순간이 존재한다. 즉, 특별한 driving force가 존재하지 않는 이 상황을 놓고 변화를 가한 system이 ‘동적 평형’ 상태에 놓여있다고 말한다. 한편, 동적 평형 상태 system은 미시적으로는 항상 움직이고 있다. 예를 들어 phase transition이 진행되는 system이 동적 평형에 놓였을 때, boundary를 통해서 미시적으로는 항상 분자들의 transition이 발생하고 있다. 다만, 전환/역전환의 비율이 같아 변화가 없어 보인다.
2. 증기압 (vapor pressure)
증기압은 액체 및 고체가 증발할 수 있는 압력을 뜻한다. 이는 증기가 고체 또는 액체와 동적평형을 이루고 있을 때의 포화증기압의 크기를 뜻한다. 이 상황을 이용하기 위해서는 증발(evaporation)와 응축(condensation)에 대한 이해가 필요하다. 액체 및 고체의 분자사이의 인력은 기체에 비해 매우 크다. 그렇기에 상대적으로 인력이 약한 표면으로부터 증발이 발생한다. 다만, 증발된 기체상의 물질은 표면에 충분한 에너지를 갖고 충돌하면 다시 응축되어 액체 또는 고체 상태로 돌아간다. 증발하는 물질의 양이 많을수록 응축이 되는 정도도 증가하기에 특정 시점이 되면 증발 정도와 응축 정도가 일치한다. 이때 해당 system은 동적 평형을 형성하며, 이때 표면 근처에서 측정한 기체의 압력을 증기압이라고 한다. 증기압의 측정을 위해서는 증발한 물질이 system 주변에 잔류해야 한다. 이를 위해서 측정은 보통 closed system에서 진행한다.
3. 상 변화 (phase transition)
1) 상 변화의 정의
특정 상황에 놓여있는 물질의 화학적 조성 및 물리적 상태를 상(phase)라고 한다. 보통 분자 사이의 거리를 기준으로 그 거리가 가까운 순으로 고체, 액체, 기체라고 분류하지만, 특정 지점에서의 특성이 이 셋과는 구별되는 경우에는 새로운 phase로 정의하여 물질의 특성을 설명한다.
2) phase stability의 기준과 상 변화 진행 이유
물질들이 갖고 있는 에너지를 gibbs energy G로 표현할 수 있다. 이는 extensive property이기 때문에 비교를 위해서 intensive property인 molar gibbs energy Gm을 chemical potential μ로 정의한다. chemical potential의 크기가 낮을수록 해당 물질이 더 안정한 상태에 놓여있다고 한다.
물질들의 변화 가능성은 ‘해당 물질이 특정 phase에서 가장 안정한 상태에 놓여있는가’를 기준으로 파악한다. gibbs energy는 state function이기에 exact derivative를 따라 infinitesimal gibbs energy를 표현할 수 있다.
dG = Vdp - SdT
maxwell relationship을 이용하면 다음과 같은 표현을 얻을 수 있다.
∂μ∂Tp=-Sm & ∂μ∂pT=Vm
이때 phase transition이 대개 등압조건에서 진행하는 것을 목표로 하기에 왼쪽의 식을 이용하면 phase transition이 진행되는 이유를 알 수 있다.
Sm은 모든 온도 범위에서 항상 양수이기에 μ 는 항상 음수이며, Sm(g)>Sm(l)>Sm(s) 의 크기관계를 갖는다. 이를 고려하여 μ-T 그래프를 얻을 수 있으며 그림 1로 표현했다.

특정 온도구간에서 물질들은 하나의 phase를 가지려 하며, 가장 낮은 μ 를 유지하려 한다. 이를 위해 system의 온도가 높아질수록 분자 사이의 거리를 늘려 안정한 상태를 유지하려 한다. 그렇기에 특정 온도를 기준으로 phase transition이 발생하며, 이 현상이 관찰되는 온도를 상 변화 온도(transition temperature)이라고 한다.
3) 상변화의 분류 (The Ehrenfest classification of phase transitions)
한편, chemical potential이 변화하는 경향을 기준으로 phase transition을 분류할 수 있는데, 이를 Ehrenfest classification이라고 하며, 그림 2처럼 표현한다.

이는 transition temperature에서 μ 의 변화 경향성을 기준으로 분류한다. 만약 해당 지점에서 μ 가 미분가능하게 연결되어 있다면 Second Order transition이라고 한다. 이 변화에서는 maxwell relationship을 이용했을 때 Vm과 Hm이 연속인 것을 알 수 있다. 반면, μ 가 미분 불가능하게 연속이라면 First Order transition이라고 한다. 이때에는 transition point에서 Vm과 Hm이 증가하는 것을 확인할 수 있다.
4. 상평형 곡선 (phase equilibrium diagram)
Theory 3에서 살펴본 순수한 물질에 대한 phase transition을 p-T의 관계를 통해서 살펴볼 수 있으며 이를 그래프로 표현한 것을 상평형 곡선(phase equilibrium diagram)이라 했다.

특히 phase boundary는 상변환이 진행되는 지점으로 두 다른 phase가 동적평형을 이루고 있다. 그림 3의 오른쪽 상평형 곡선을 기준으로 AT를 승화곡선, BT를 융해곡선, CT를 증기압력곡선이라고 하며 각각 고체, 액체, 기체의 증기압력을 표현한 것이다. 물의 융해곡선은 다른 물질과 달리 음의 기울기를 갖는데 이는 물의 밀도 변화 경향성이 다른 물질과 그 특성을 달리하기 때문이다. 추가적으로 T는 고체, 액체, 기체가 동시에 존재하는 삼중점이며, C는 임계점으로 증기압력곡선의 최대값이 형성되는 점을 말한다. 그림 3의 phase diagram은 순물질에 대한 것으로 정확한 수치를 얻으려면 system을 한 물질로 빈틈없이 채운 후 p와 T를 조정하면서 나오는 특성들을 측정해야 한다.
5. Clausius-Clapeyron equation
액체의 아래 첨자를 1, 증기의 아래 첨자를 2라고 하자.
상 변화 과정에서 동적 평형을 이루고 있으므로 (가정)
dμ1=dμ2⋯①
이때 G = H - TS, H = U + pV 이므로 이 수치들을 infinitesimal scale에 대해 표현하고 chemical potential을 표현하기 위해 단위 몰 당 수치를 얻으면
dμ=Vmdp-SmdT⋯②
①, ②를 이용해서 식을 정리하면
Vm,1dp-Sm,1dT=Vm,2dp-Sm,2dT⇒dpdT=∆Sm∆Vm⋯③
VLE에서는 온도 변화가 없으므로 G = H - TS를 통해서 ∆S=∆H/T 임을 얻을 수 있으며 상 변화 중 ∆Vm=Vmg-Vml 이지만, 기체의 몰 부피가 액체에 비해 매우 크기에 무시하면 (가정)
dpdT=∆HmTVmg⋯④
infinitesimal property에 대해 macroscopic property로 전환하기 위해서 적분을 진행해야 한다. 이때 생성되는 기체를 이상적이라 하고 (가정), 상 변화 중 필요한 열의 양이 온도에 대해 독립적이라고 하면 (가정)
Vmg=RTp⇒lnpP0=-∆HmR1T+C⋯⑤
이 식을 Clausius-Clapeyron equation이라고 하며, lnp와 1/T에 대해 plot해서 얻은 그래프의 기울기를 이용하면 해당 phase transition에서의 필요한 열의 양(엔탈피)를 얻을 수 있다. P0 은 log의 진수 부분에는 무차원수를 사용해야 하기 때문에 붙여준 수치이며 실험에서 사용한 단위를 따른다. C는 plot된 그래프에 의해서 정해지는 상수다. 이를 무시하고 싶으면 두 상태에 대해 Clausius-Clapeyron equation를 적용한 아래의 식을 이용하면 된다.
lnpapb=-∆HmR1pa-1pb
6. 기체의 상태 표현
1) 이상기체 상태 방정식
기체분자운동론을 만족하는 기체를 이상기체(ideal/perfect gas)라고 하며, 몇 가지 property에 대한 아래의 관계식이 성립한다.
pV=nRT
(p: 기체의 압력, V: 부피, n: 기체의 몰수, R: 기체 상수, T: 기체의 온도)
2) 실제 기체 방정식
하지만 실제 기체는 이상기체와 달리 고유의 부피를 갖고 있으며, 분자 사이의 상호작용이 존재한다. 이처럼 이상기체 방정식에서 실제 기체가 보이는 거동성을 반영하여 이상기체 상태방정식을 기반으로 modeling한 여러 식이 있는데, 대표적인 몇 가지에 대해 살펴보겠다.
① Viral Coefficients와 Compressibility factor
이상기체 상태 방정식을 power series형태로 expansion하여 실제 기체의 거동성을 수학적으로 해석할 수 있도록 만든 식이다.
pVm=RT1+BVm+CVm2+⋯
여기서 표현되는 B와 C를 Viral Coefficient라고 한다. 다만, C는 B의 비해 매우 작은 경우가 많기에 편의를 위해서 계산 시 C에 대해 무시하고 계산하는 경우가 많다. Virial Coefficient는 온도에 의한 함수 B(T), C(T) 등으로 표현된다.
식의 길이가 길어지는 것을 방지하기 위해 이상 기체의 몰 부피에 대한 실제 기체의 몰 부피의 비율을 compressibility factor Z로 정의하고, 이를 이상기체 방정식에 적용한다.
pVm=ZRT
(Vm: 실제 기체의 몰부피, Z: compressibility factor)
한편, 위의 두 식을 p, V, T에 대해 정리하여 표현하면 Viral Coefficient와 Compressibility factor 사이의 관계성을 확인할 수 있다. C를 무시하면,
Z=pVmRT=1+BVm+CVm2+⋯⇒ Z=1+BpRT
② Vander Woals Equation과 reduced property
이상기체와 실제 기체 사이의 거동성의 차이 중 기체 자체의 부피 및 기체 사이의 상호작용을 주요 차이점으로 두고 이상기체 식을 개선한 것을 Vander Woals Equation이라고 한다.
p=RTVm-b-aVm2
원래는 a와 b는 기체의 종류마다 다른데, critical point에 대한 현재 상태의 비율을 통해 얻은 reduced property를 이용하면 이 방정식을 기체의 종류와 관계없이 적용할 수 있게 된다.
Ⅳ. Apparatus & Chemicals
Chemicals
|
물질 이름 |
화학식 |
화학식량(g/mol) |
밀도(g/mL) |
녹는점(℃) |
끓는점(℃) |
|
증류수 |
H2O |
18.019 |
1.00 |
0 |
100 |
표 SEQ 표 \* ARABIC 1 실험에서 사용하는 물질의 정보
Ⅴ. Procedure
1. Round-bottom flask에 증류수 100mL를 넣는다.
2. 냉각기와 Reflux condenser를 연결한다,
3. 냉각기의 스위치를 켜고 냉각수의 온도가 15℃ 이하가 될 때까지 기다린다.
4. Vacuum pump를 작동시켜 manometer의 눈금이 200mbar가 될 때까지 감압한다.
5. Heating mantle의 전원을 켜고 온도를 천천히 증가시킨다.
6. 물이 끓을 때까지 기다린다.
7. 물이 끓었을 때의 manometer와 온도계의 압력과 온도를 측정하여 기록한다.
8. Stopcock를 열고 공기를 주입하여 manometer의 눈금을 상승시킨다.
9. 200mbar부터 1013mbar까지 5 point 이상 압력조건에서 물이 끓을 때의 온도를 측정한다.
10. 실험을 2회 반복한다. 실험을 종료한 후 장갑을 끼고 round-bottom flask를 정리한다.
Ⅵ. Data & Result
1. 실험 1
|
P (mbar) |
ln(P/P0) |
T (℃) |
T (K) |
T-1 (K-1) |
|
215 |
5.370 |
57.9 |
331.05 |
0.00302 |
|
410 |
6.016 |
73.7 |
346.85 |
0.00288 |
|
615 |
6.421 |
83.8 |
356.95 |
0.00280 |
|
805 |
6.690 |
91.8 |
364.95 |
0.00274 |
|
990 |
6.897 |
98 |
371.15 |
0.00269 |
|
1013 |
6.920 |
100 |
373.15 |
0.00267 |
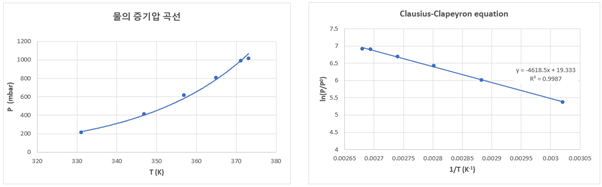
2. 실험 2
|
P (mbar) |
ln(P/P0) |
T (℃) |
T (K) |
T-1 (K-1) |
|
210 |
5.347 |
60 |
333.15 |
0.00300 |
|
410 |
6.016 |
75 |
348.15 |
0.002587 |
|
610 |
6.413 |
84.7 |
357.85 |
0.00279 |
|
804 |
6.689 |
80.2 |
353.35 |
0.00283 |
|
990 |
6.897 |
97.8 |
370.95 |
0.00269 |
|
1013 |
6.920 |
100 |
373.15 |
0.0267 |
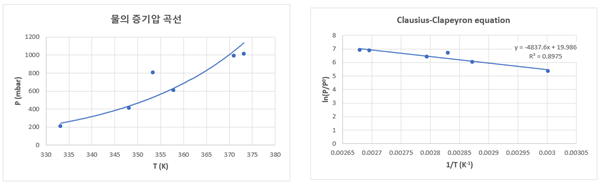
3. 실험 결과 정리 및 오차율
|
|
plotted equation |
신뢰도 |
slope |
∆Hvap,m (kJ/mol) |
오차율 (%) |
|
실험 1 |
ln(P/P0)=-4618.5(1/T)+19.333 |
0.9987 |
-4618.5 |
38.398 |
5.554 |
|
실험 2 |
ln(P/P0)=-4837.6(1/T)+19.986 |
0.8975 |
-4837.6 |
40.220 |
1.072 |
|
문헌값 |
ln(P/P0)=-4890.1(1/T)+C |
∙ |
-4890.1 |
40.656 |
∙ |
Ⅶ. Discussion
이 실험은 특정 압력에서 물의 끓는점을 측정하여 증기압력과 끓는점 사이의 관계를 이해하는 것을 목표로 한다. 사용하는 물질의 특정 지점에서의 state를 결정하기 위해 phase rule에 대해 고민해볼 필요가 있다. air에 대해 무시했을 때 liquid to vapor transition이 발생하는 지점에서 # component = 1, # phase = 2 이므로 #DOF = #component - # phase + 2 = 1 -2 + 2 = 1이다. 즉, T와 p 중 한 가지 값만 결정하면 나머지 값도 결정되는 것을 알 수 있다. 실험 상에서 온도는 열을 다루어 조정하는데, 열은 관성을 갖고 있기에 원하는 수치로의 자유로운 조정이 힘들기에, 압력을 결정짓고 끓는 점의 온도를 측정하는 방법으로 실험을 설계했다. 실험에서 압력은 manometer를 이용해서 측정한다. 이는 gauge pressure을 표현해줌으로써 system의 순수한 압력을 표현되도록 한다.
물의 기화는 대표적인 1st order phase transition이기에 phase가 변할 때 molar volume과 molar enthalpy가 급격하게 변한다. 특히 엔탈피 변화는 몇 가지 가정을 이용해서 얻은 선형 방정식 Clausius-Clapeyron equation을 이용해서 구할 수 있다. 실제 진행한 실험 환경과 theory 5에서 설정한 가정들을 비교하여 오차 발생 원인 및 실제 값은 어떻게 나올지를 비교해보자. (discussion의 더 나은 전개를 위해 4가지 가정에 대해 임의로 번호를 매겼다.)
(가정 1) 분석하고자 하는 증기가 이상기체이다.
증발을 통해 형성되는 기체 분자를 온전한 이상기체로 고려하기에 실험 환경은 온도가 낮으며 어느정도 압력이 가해지고 있다. 그렇기에 Compressibility factor를 이용해서 실제로 slope은 어떠한 수치를 갖게 될 것인지 확인해보자. 특정 지점에서 Z=pVm/RT=1+Bp/RT 이므로,
dpdT=∆Hvap, mTVmg=∆Hvap, mZRT2 ⇒ lnpP0=-∆Hvap, mZmeanR1T+C
slope=m=-∆Hvap, mZmeanR⇒∆Hvap, m=-ZmeanRm=Zmean∆Hvap,m
second virial coefficient table for water에 나와있는 수치에 대해 linear interpolation을 적용하여 실험에서 사용한 온도에서의 B의 값을 얻었다. 이 값들에 의해 결정된 Z를 적분을 이용한 평균값 정리를 통해서 실험한 압력 구간에 대한 Zmean 을 결정했고, 이를 이용해서 얻은 보정된 수치 ∆Hvap, m 를 표 5에 정리했다.
|
|
slope |
Z(min, max) |
Zmean |
∆Hvap,m |
∆Hvap, m |
변화율(%) |
비고 |
|
실험 1 |
-4618.5 |
(0.98402,0.99434) |
0.98795 |
38.398 |
37.935 |
1.21 |
감소 |
|
실험 2 |
-4837.6 |
(0.98401,0.99451) |
0.99048 |
40.220 |
39.837 |
0.952 |
감소 |
표 5 실제 기체임을 고려하여 계산한 mean compressibility factor 및 ∆Hvap, m
실제 기체라고 생각했을 때 구한 엔탈피 변화는 실험 1과 2에서 모두 이상기체일 때보다 감소한 것을 확인할 수 있다. 이 결과는 정성적으로도 설명이 가능하다. 실험은 적당한 압력과 온도 하에서 진행되기 때문에 기체 분자들의 attraction이 우세한 상태에 놓여있다고 생각할 수 있다. 그렇기에 이상기체에 비해 실제 기체 분자들의 거리는 비교적 짧다. 즉, 액체 상태의 물이 이상 기체가 되는 데 비해 더 짧은 정도의 거리만 떨어지면 되므로 더 적은 에너지가 있어도 충분히 phase transition이 진행될 수 있다. 다만 이 modeling 방법도 한계가 존재한다. Z도 T에 대한 함수로 표현될 수 있음에도 이 값을 상수로 고려하여 equation을 얻었다는 점이다. Vander Woal’s equation에서 표현된 몰 부피 혹은 virial equation에서 표현된 몰 부피를 바로 대입해서 식을 얻는다면 비교적 정확한 분석이 가능할 것이다. 다만, 정성적인 설명에 따라 엔탈피 값의 변화 경향성은 Z를 이용한 modeling과 같을 것이며 변화 정도에만 차이가 있을 것으로 예상된다.
(가정 2) 기체의 몰 부피가 액체에 비해 매우 크기에 무시한다. ∆Vm=Vmg-Vml≈Vmg
만약에 반응 system의 크기가 충분히 크다면 이 가정에 대해서는 크게 언급할 필요가 없지만 실험 scale이 그 정도는 아니기에, 만약 계산과정에서 Vml 을 고려하면 어떻게 될 지 생각해보자. 어떤 vapor-liquid system이 liquid to vapor transition을 겪고 있다고 하자. 이때 기체의 몰 부피는 system의 온도와 압력에 의해 결정되며 물의 몰 부피는 거의 일정하다. 이를 설명한 것이 아래의 그림 7이다.

위에서 얻은 ∆Vm=RT/p-k 를 활용하여 식을 전개하면,
dpdT=∆HmT∆Vm=∆HmTRT/p-k
위의 first order nonlinear ODE를 풀면,
C1+Ei-k∆Hmp+∆Hmek∆HmpRT=fx,y=0 (Ei(x): exponential integral function)
하지만 위의 식은 implicit function이며 Ei(x)를 exponential하게 표현하는 것에는 어려움이 있다. 그렇기에 RT/p와 k의 unit은 cm3/mol으로 동일할 수 있는 사실을 이용하자. k는 항상 양수이므로 기체의 부피는 액체의 몰 부피를 무시했을 때보다 감소한다. 물의 부피를 무시했을 때보다 기체가 이동할 수 있는 부피의 감소한 정도를 비율 상수 a로 정의하고 이를 이용해서 표현하면,
dpdT=∆Hvap, mTRT/p-k≈∆Hvap, mTaRT/p=∆Hvap, mpaRT2⇒lnp=-∆Hvap, maR1T+C
slope=m=-∆Hvap, maR⇒∆Hvap, m=-aRm=a∆Hvap,m
(a(T): T에 대한 함수로 표현되는 비율 상수, 0<a(T)≤1))
이 유도를 통해서 정확히 어느 정도 값이 변화하는 것은 알기 힘드나, 물의 부피가 고려되는 상황에서의 증발 엔탈피가 그렇지 않은 경우보다 더 작다는 것을 알 수 있다. 다만 H2O(g) 몰 부피는 매우 H2O(l) 보다 매우 크기에 a의 값이 1에 수렴할 것이고 구체적으로 값을 구하더라도 큰 변화는 없을 것으로 예상된다.
(가정 3) 증발 시 필요한 엔탈피의 양은 온도에 대해 독립적이다.
엔탈피를 온도에 대해 독립적이라고 이야기했지만, 엔탈피 H를 maxwell relationship을 이용하면 exact differential dH = TdS + Vdp인 것을 알 수 있다. 즉, 실제 엔탈피는 측정하는 환경(온도, 압력 등)에 의해 영향을 받으며 phase transition을 분류한 그림 2에서도 이를 확인할 수 있다. 다만 모든 온도 구간에 대해 구하는 것은 많은 시간과 비용이 요구되므로 몇몇 지점에 대해서만 측정을 진행했으며 least squares approximation (이하 LSA)을 이용해서 얻은 그래프를 분석이 사용했다. LSA는 특정 지점들의 정보에만 의존하기에 한 부분의의 측정이 잘못되면 얻고자 하는 것과 차이가 날 수 있다. 실제 실험 1의 정확도 R은 99%로 확인되는 반면 실험 2는 89%로 비교적 신뢰도가 낮은 편에 속한다. 증발 시 필요한 엔탈피의 실제 크기는 Properties of Saturated Steam Table을 통해서 확인할 수 있다. Table에 없는 수치는 linear interpolation을 이용했으며 오차율은 (실험 - 문헌정보)/실험*100(%)를 각 실험에 대해 적용했다.
|
T(K) |
331.05 |
333.15 |
346.85 |
348.15 |
353.35 |
356.95 |
357.85 |
364.95 |
370.95 |
371.15 |
373.15 |
|
|
Hvap(kJ/mol) |
42.600 |
42.490 |
41.880 |
41.822 |
41.584 |
41.418 |
41.378 |
41.048 |
40.763 |
40.753 |
40.658 |
|
|
Hvap(kJ/mol) |
실험 1 - 38.398 실험 2 - 40.220 |
|||||||||||
|
±오차율 (%) |
실험 1 |
-10.94 |
|
-9.07 |
|
|
-7.87 |
|
-6.90 |
|
-6.13 |
-5.89 |
|
실험 2 |
|
-5.64 |
|
-3.98 |
-3.39 |
|
-2.88 |
|
-1.35 |
|
-1.09 |
|
표 6 Steam table에서의 엔탈피 값과 실험에서 얻어진 엔탈피 값에 대한 증/감 표현 오차율
실험 1과 2 모두 실제 포화 상태의 온도가 아닌 구간에 대한 값들을 계산한 것이기에 정량적인 분석은 불가능 하다. 실제 측정되어야 하는 값보다는 더 적은 에너지가 필요하다고 측정되었다는 정보만 절댓값을 취하지 않은 오차율을 통해서 생각해볼 수 있다. 보다 주목해야 하는 점은 포화상태가 형성되는 지점에서의 온도가 증가할수록 상변화 시 필요한 엔탈피의 값이 작아진다는 것을 정성적으로 이해하는 것이다. 온도가 올라갈수록 액체의 물 분자는 더 높은 에너지를 갖고 있는 상태를 유지한다. 그렇기에 기체상태가 되기 위해서는 보다 적은 에너지만 가해주면 되는 것이다.
위의 가정 1 ~ 가정 3을 살펴봄으로써 실제 물이 끓기 위해서는 이상적인 상황하고 약간 다를 수 있다는 것을 알 수 있다. 그 중 1013mbar에서 측정한 수치에 대해 이야기를 해보자. 이 압력의 크기는 알려져 있는 대기압의 크기(1atm=1.013bar=760torr)와 부합한다. 이 지점에서의 물의 끓는 점은 100℃이며 두 번의 실험에서 이와 부합한 것으로 나타났다. 하지만 IAEA(International Atomic Energy Agency)에 따른 계량법에 따르면 대기압 하에서의 물의 끓는점을 99.98℃으로 정의한다. 이 차이는 실제 지구상에서 원소들의 동위원소가 존재하기 때문에 발생했다. 불순물이 포함된 바닷물 중 순수한 물에 대해, 동위원소를 포함하고 있는 물분자들의 비율을 고려하여 IAEA는 그 기준을 정했다. 이렇게 정의한 물을 VSMOW(Vienna Standard Mean Ocean Water)이라고 하며, 이를 이용해서 계량을 진행하면 물의 물리적 거동성을 보다 정확하게 설명할 수 있으며 다른 물성 측정의 기준으로 사용된다. 계량에 사용하는 물이 동위원소를 포함하지 않는 H2O여도 끓는점이 정확히 100℃가 아닐 수 있다. 대표적으로는 대기압을 정의한 상황과 실제 상황이 부합하지 않는 경우를 이유로 들 수 있다. 압력의 단위로 사용하는 torr는 0℃ 상에서의 수은 1mm가 갖는 압력을 표현한 것이다. 하지만 대부분의 끓는점은 상온에서 측정되기에 오차가 생길 수 있다. 또한 대기압은 공기의 무게를 기준으로 정의한 단위이다. 그렇기에 대기의 상태에 따라서 영향을 많이 받는다. 예를 들어 태풍이 형성되면 주변 공기의 압력이 낮아지기에 끓는점이 내려갈 수 있다. 그 외에도 공기 중의 기체 들이 실제로 물에 용해될 수 있기에 사용하는 물이 순수한 물이 아닌 점을 들 수 있다. 이를 예방하기 위해서 증류수를 사용해야 하며, 증류수만 포함되어 있는 피스톤을 준비한 후 실험을 진행해야 한다. 하지만 이번 실험에서는 이러한 점이 지켜지지 못했기에 Clausius equation을 유도할 때 했지만, 미처 살펴보지 못한 마지막 가정에 대해서 이야기하겠다.
(가정 4) 상 평형 진행 중에는 liquid H2O와 vapor H2O는 평형을 이루고 있다.
실험 중 온도를 측정하는 순간은 우리가 액체의 끓음을 관찰하는 순간이다. 하지만 열의 전달이 infinitesimal하게 잘 진행이 되었다면 물은 over-boiled될 수 있다. 이는 물의 상변화가 phase transition을 따르며 수학적으로 subcritical Pitchfork Bifurcation으로 해석될 수 있기 때문에 생각될 수 있는 상황이다. 즉 끓는 점이 되었음에도 불구하고 끓음이 발생하지 않을 수 있다. 하지만 이 현상의 확률은 거의 낮으며 그렇기에 기체와 액체 상태의 물이 서로 동적 평형을 이루고 있는 것은 맞다고 할 수 있다. 다만 이 평형을 단순히 순수한 물에 대한 평형상태로는 살펴보기 힘들다. vacuum pump 및 stopcock를 이용해서 실험 system의 압력을 조정하는데 그 크기는 물이 아닌 기체인 공기의 출입으로 조정되기 때문이다. 그렇기에 이번 실험은 물을 condensable component로 갖는 gas-liquid system 하에서 증기압을 측정했다고 생각하고 현상들을 설명해야 한다. 이 system에서 Rault’s Law for single condensable species이다. 이 개념은 gas-mixture에서 condensable species의 partial pressure가 시스템에서의 pure-component vapor pressure와 같다는 것을 의미하며, 식으로 나타내면 아래와 같다. 여기서는 water이 condensable하기에,
Pw=ywP=P*w(T)
즉, 우리가 측정했던 증기압은 공기 + 기체상의 물이었던 것이므로 Rault’s Law를 적용하여 순수한 물에 대한 증기를 얻어낸 뒤, 이에 대해서 다시 Clausius- Clapeyron equation을 적용해서 해석해야 한다. Properties of Saturated Steam Table을 이용해서 관측된 boiling point에 대응되는 압력은 기체상태일 때의 순수한 물의 압력이다. 이를 이용해서 system에서의 공기의 몰분율, 물의 몰분율을 각각 얻을 수 있으며 이 정보를 통해 얻은 순수한 물의 압력을 얻어낼 수 있다. 이를 바탕으로 얻은 Clausius- Clapeyron equation의 기울기로 필요한 엔탈피의 양을 다시 계산해보자.
|
|
equation |
신뢰도 |
Zmean |
∆Hvap,m (kJ/mol) |
비고 |
|
실험 1 |
ln(P/P0)=-4618.5(1/T)+19.333 |
0.9987 |
0.98795 |
37.935 |
|
|
실험 1 pure-w |
ln(P/P0)=-5050.4(1/T)+20.443 |
0.9995 |
0.98840 |
41.502 |
|
|
실험 2 |
ln(P/P0)=-4837.6(1/T)+19.986 |
0.8975 |
0.99084 |
39.837 |
|
|
실험 2 pure-w |
ln(P/P0)=-5047.5(1/T)+20.453 |
0.9998 |
0.98940 |
41.520 |
|
표 7 Rault’s Law를 적용해서 얻은 pure water vapor (partial pressure)에 대한 정보
system의 model을 변형하여 얻은 정보를 표 7에 정리했다. 이 표에서 몇 개의 사실들을 확인할 수 있다. 우선, pure-water에 대한 정보가 매우 유사한 것을 확인할 수 있으며 증발 엔탈피가 41.5kJ/mol 정도인 것을 얻었다. 이는 앞서 표 6에서 표현한 온도 범위에 대한 엔탈피 값 중 중앙값과 유사한 수치이기에 온도의 분포에 대한 엔탈피 값이 잘 계산되었음을 확인할 수 있다. 그리고 두 equation의 신뢰도가 상승했으며, 특히 실험 2의 경우는 중간에 있던 noise값이 사실은 공기에 의했던 것을 확인할 수 있다. 이를 통해서 우리가 실험한 system이 gas-liquid system인 것을 다시 확인할 수 있으며, 이 상황에서의 분석은 Rault’s law가 적용되어야 하는 것을 알 수 있다.
증기압에 대한 논의는 화학공학 및 열역학에서 많이 논의되는 주제 중 하나이다. 실제로는 순물질보다는 용액이 2개 이상의 액체로 구성이 된 경우를 많이 다루게 되며, 이러한 용액의 거동성은 분별증류 등에 적용된다. 많은 석유 등 많은 액체 혼합물이 있겠지만 그 중에서도 2종류의 volatile liquid로 이루어진 ideal solution은 어떤 거동성을 보이는지 살펴보자. 이 혼합 용액 또한 Rault’s law를 이용하여 해석한다.
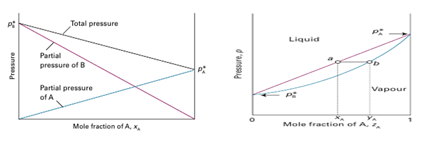
A와 B를 volatile한 liquid이며 두 liquid가 solution을 구성하고 있다고 하자. 이때, 두 물질의 조성에 따라서 형성되는 증기압의 크기는 바뀔 것이다. 이때 해당 용액의 전체 증기압은 기체의 몰 분율을 이용해서 표현할 수 있으며 이는 액체의 몰분율과 차이가 있다. 이는 두 용매 사이의 volatility가 다르기 때문이다. 그림 8의 왼쪽의 그림에서 보다 liquid-vapor의 정보를 모두 표현하고 싶을 때 그림 8의 오른쪽의 그림으로 p-z(fraction)선도를 얻는다. 이는 lever rule 등을 이용해서 해당 system이 갖고 있는 intensive property에 따라서 어떻게 액체의 조성이 구성되는지, 증기압의 조성이 구성되는 지를 해석할 수 있게 돕는다.
Ⅷ. References
1. Atkins, P W, and Paula J. De. Atkins' Physical Chemistry. Oxford: Oxford University Press, 2010.
2. Smith, J. M. (Joseph Mauk), Introduction To Chemical Engineering Thermodynamics. New York: McGraw-Hill, 2018
3. Felder, R. M., & Rousseau, R. W, Elementary principles of chemical processes. New York: Wiley, 2018
4. Allan H. Harvey and et. al, Correlation for the Second Virial Coefficient of Water, J Phys. Chem. Ref. Data, Vol 33, No. 1, 2004
5. IAEA, Reference Sheet for International Measurement Standards, VSMOW & SLAP reference sheet, 2006
'자료.zip > 화공생명공학전공실험' 카테고리의 다른 글
| PCR + 전기영동 (0) | 2021.02.01 |
|---|---|
| FT-IR 분석 실험 (0) | 2021.02.01 |
| 접촉각 측정 (Contact Angle) (1) | 2020.12.17 |
| Grignard Reagent를 이용한 Triphenylmethanol synthesis 실험 (0) | 2020.10.28 |
| Differential Scanning Calorimeter (DSC) pre report (1) | 2020.09.01 |