
1. system & surrounding
1) system의 종류
어떤 반응 정보를 해석할 때 우주(universe) 전체를 고려하는 것이 아닌, 관심 있는 부분을 분석한다. 이를 계(system)이라고 하며, 이를 제외한 나머지 부분을 surrounding이라고 한다. system과 surrounding의 boundary를 기준으로 열과 물질의 흐름 여부를 따라 system을 다음과 같이 분류할 수 있다.
|
|
열의 흐름 |
물질의 흐름 |
|
open system |
O |
O |
|
closed system |
O |
X |
|
isolated system |
X |
X |
2) system에서 진행되는 반응에 의한 열교환
system이 isolated만 아니라면 system과 surrounding 사이에서 열 교환이 발생할 수 있다. system에서 진행되는 반응에 의해 열이 유입되면 이 system에서 진행되는 반응을 흡열 반응 (endothermic reaction)이라고 한다. 반대로 system내의 반응에 의해서 system의 온도가 내려간다면 이 반응을 발열 반응 (exothermic reaction)이라고 한다.
2. 내부에너지와 엔탈피
1) 내부 에너지 (internal energy)
system의 전체 에너지를 의미하며 potential energy와 kinetic energy의 합을 의미한다. 한편, isolated system에서는 system에 가해진 일 w 또는 열 q에 의해서 internal energy의 변화량을 측정할 수 있다.
∆U=w+q
2) 엔탈피 (enthalpy)
internal energy와 달리 system의 volume이 자유롭게 별할 수 있을 때 내부 에너지의 변화는 system의 부피 변화를 유발할 수 있기 때문에 항상, 가해진 열에 비하여 변화하는 정도가 작다. 즉, 압력이 일정한 상황에서 외부에서 가해준 열 에너지를 내부의 enthalpy 변화량과 같다고 정의하고, 이를 식으로 표현하면 다음과 같다.
H=U+pV ⇒ ∆H=qp
한편, 우리가 생각하고 있는 일반적인 상황은 closed or isolated system이다. 하지만, open system에서 엔탈피를 설명할 수 있다. 유체가 open system을 형성하는 것은 특정 공간을 정상적으로 흐르고 있음을 의미한다. 유체가 갖는 내부 에너지를 U 라고 할 때 이를 제외하고 유체를 흐르게 할 수 있는 일(에너지)이 필요하다. 일반적으로 기체의 일은 expansion work를 따르므로 에너지 pV 에 의해 기체가 흐르며, 이를 유동에너지라고 한다. 내부에너지와 엔탈피의 개념을 이용하면 다음과 같은 식을 유도할 수 있다.
dU=dw+dq=-dpV+dq
dH=dU+d(pV)
dH=dq ⇒ ∆H=q
이는 flow system에서는 열량의 변화량이 엔탈피의 변화량임을 알려준다.
3. 고분자 물질의 특성
1) 고분자의 특이적 거동
고분자는 일반적인 단분자와는 다른 거동성을 보인다. 단순히 크기만 커서 그런 것은 아니며, 아래의 세 가지 이유 때문이다.
① 사슬의 뒤얽힘 (chain entanglement)
고분자가 단량체 사이의 결합에 의해서 형성된다 단량체를 A라고 했을 때 단순한 -A-A-A-A- 형태로 존재한다고 생각할 수 있다. 하지만. 단량체 사이의 상호작용에 의해 유연한 형태로 존재한다. 즉, 항상 선형성을 보이는 것이 아니라 서로가 꼬인 형태로 존재할 수 있다. 그래서 특정 온도에서는 고 분자를 쉽게 늘일 수 있지만, 또 어떤 온도에서는 고분자에 변형을 주는 것이 어렵다.
② 분자 사이의 상호작용에 의한 가중 (summation of intermolecular force)
분자 사이에서는 다양한 상호작용이 존재한다. 일반적으로 공유결합, 이온결합, 수소결합, 쌍극자-쌍극자 결합, Van der Waals 상호작용이 존재한다. 고분자는 많은 단량체로 구성이 되어 있기 때문에 각각의 상호작용이 서로 중첩될 수 있다. 즉, 고분자 사이의 상호작용이 강해질 수 있어 예상과는 다른 경향성이 관찰될 수 있다.
③ 느린 움직임 (slow motion)
작은 분자는 독립적으로 행동할 수 있기 때문에 빠른 속력을 가질 수 있다. 하지만, 고분자는 작은 분자들이 결합한 형태로 존재하기 때문에 각 단량체의 움직임들에 의한 알짜 움직임을 관찰할 수 있다. 따라서 고분자는 매우 느린 움직임을 보이며, 이는 용액에서 점도를 결정하는데 영향을 미친다.
2) 고분자의 가열과 상전이
고분자 물질도 물질의 한 종류이기 때문에 가열을 하면 상이 변화한다. 하지만, 단순한 분자들과는 달리 위의 언급한 고분자만의 거동성 때문에 일반적으로 분자와는 다른 몇 가지 물리적 상태를 관찰할 수 있다.

① 유리 전이 온도 (glass transition temperature Tg)
유리와 같은 비정질 고체가 가열에 의해 점성이 있는 상태로 변화할 수 있는 지점을 유리 전이 온도라고 한다. 예를 들면 고체 상태로 존재한 고분자가 고무 같은 상태로 변하는 지점을 뜻한다. 즉, 고분자가 움직이기 시작하는 지점을 의미한다. 고분자는 같은 구조가 지속적으로 관찰되기 때문에 측정 사슬을 단위 길이(segment)로 본다. 각 단위 사슬은 온도가 증가하면 회전을 할 수 있는데, 이 상태의 온도는 유리 전이 온도를 갖는다. 유리 전이 온도는 DSC를 이용하면 측정을 할 수 있으며, 이에 대해서는 DSC 부분에서 자세하게 소개하겠다.
② 결정화 온도 (crystalline temperature Tc)
안정 상태에 있는 고분자는 기본적으로 사슬이 얽힌 상태, 즉 무정형 상태(amorphous state)로 존재한다. 하지만, 특정 온도에 도달하면 고분자가 준 결정화 상태(semicrystalline state)에 도달한다. 이 현상이 나타나는 지점의 온도를 결정화 온도라고 한다. 결정화 온도가 될 수 있는 지점은 넓으나 결정 생성이 가장 빠르게 진행되는 지점의 온도를 결정화 온도로 정의한다.
③ 용융온도 (melting temperature Tm)
용융 온도는 고분자가 고체 상태에서 액체 상태로 변화할 수 있는 지점을 의미한다. (비결정성 고분자의 경우는 논의에서 제외한다,) 다만, 그 기준을 명확하게 할 필요가 있다. 결정이 열에 의해서 모두 녹아 용융 상태가 될 때까지 가해진 열은 상변화 온도와 같이 잠열로써 물질에 흡수된다. 결정성 고분자의 경우에는 최후의 결정이 용융화 될 때의 열을 용융점이라고 한다.
4. 열 분석 (Thermal Analysis)
특정 물질이 용해하는 등 상태의 전이가 발생할 때 물리적이 상태가 변하며, 이 과정에는 항상 열이 흡수되거나 방출된다. 열을 표현할 수 있는 지표는 다양하나, 각각의 특성에 맞는 측정 방법이 존재한다. 열 분석 방법에는 어떤 종류가 있는지 아래의 표로 정리했다.
|
물리적 변수 |
열 분석 기술 |
측정 변수 |
|
|
열용량, 엔탈피 |
DTA |
Differential Thermal Analysis |
에너지 변화 dH/dt |
|
DSC |
Differential Scanning Calorimetry |
온도 변화 dT |
|
|
중량 |
TGA |
Thermogravimetry |
무게 |
|
기계적 특성 |
TMA |
Thermomechanical Analysis |
부피변화 dL/dV |
|
DMA |
Dynamic Mechanical Thermal Analysis |
Damping의 변화 |
|
1) DTA와 DSC의 비교
이 중에서 이번 실험에서는 DTA와 DSC에 대한 실험을 진행하므로, 이에 대해서 살펴보도록 하자. 각각의 특징을 간단하게 개괄해보도록 하자. DTA는 온도에 변화에 따라 시료 및 기준물질 사이에 발생하는 온도차를 측정하는 것이며, DSC는 온도의 변화에 따라 시료와 기준 물질 사이에서 흐르는 열의 양을 측정하는 방법이다. 즉, 두 방법 모두 에너지의 변화가 수반됨을 알 수 있다. 두 열분석 방법의 특징을 비교해보도록 하자.
|
|
DTA |
DSC |
|
측정 방식 |
시료-기준물질 온도 차이 측정 |
시료-기준물질 온도 보정을 위한 열량 |
|
열량 측정 |
정확한 측정 어려움 |
측정 가능 |
|
승온 속도 |
열변화 지점에서 승온 속도 변화 |
승온 속도 항상 일정 |
|
기준선 복귀 |
기준선 복귀에 어느정도 시간 필요 |
기준선 복귀 빠름 |
|
시행 온도 |
고온에서 사용 가능 (1000℃ 이상) |
550℃ 이상 사용 힘듦 |
|
사용 시료 |
금속, 무기물에 주로 사용 |
유기물, 종종 무기물 |
두 분석 방식은 각 특징에 대해 서로 다른 성격을 갖고 있다. 이제 각 측정 방법의 원리를 살펴보도록 하자.
2) DTA(Differential Thermal Analysis)의 원리와 특징
DTA는 일정한 속도로 시료에 온도 변화를 주었을 때 reference와 시료 사이의 온도 차이를 측정하고 이를 열량으로 변환하여 그 값을 측정하는 것이다. DTA 실험은 시료(s)와 reference(r)사이의 온도 차이를 측정하고 온도를 측정하여 온도를 표현하고 두 온도 사이의 차이를 그래프로 표현할 수 있다.

∆T 그래프에서 peak가 시작하는 지점은 반응의 시작 혹은 상전이의 시작을 의미한다. 또한 peak의 정점은 해당 반응이 종결되는 지점을 의미한다. Tg는 유리전이 온도, Tc는 결정화 온도, 쓰은 용융 온도, Td는 산화 온도를 말하며, 온도를 더 가하게 되어 시료가 분해되는 지점도 존재할 수 있다.
3) DSC(Differential scanning Calorimetry)의 원리와 특징
DSC는 온도 변화에 대한 시료의 에너지 변화를 측정하는 열 분석 방법이다. 다만, reference와 시료에 동시에 열변화를 주어 reference와 시료가 갖는 에너지 차이를 함수로 표현한다. DSC는 일반적으로 전력 보상 DSC (power compensation DSC)와 열 흐름 DSC (heat flux DSC)이 있다.
① 전력 보상 DSC (Power Compensation DSC, 이하 PC-DSC)
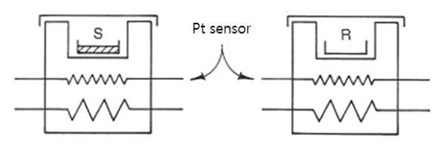
PC-DSC는 시료와 reference를 가열을 각각 분리하며, 가열로도 독립적으로 분리되어 있다. 다만, 각각의 가열로는 Pt reinforcement(Pt sensor)로 연결이 되어 있다. 시료의 온도가 변하면 reference와 시료의 온도 차이를 감지하여 이를 보완하기 위해 전기에너지를 공급한다. 즉, 일정한 압력이 가해진 상황에서 이동한 에너지를 측정하므로 dH/dt를 온도에 대한 함수로 표현한다. 한편, DSC 곡선에서도 peak가 관찰되는데 peak의 크기는 엔탈피의 변화와 비례한다.
peak의 넓이=k∆H
다만, 전기에너지의 변화를 이용해서 에너지 변화를 측정하는 것이므로, 시료 및 장치의 열용량, 열전도도 등은 k값에 영향을 주지 않는다. 즉, 상수 k 단순한 값의 환산을 위해 사용된 것이며 온도를 독립변수로 갖지 않는다.
PC-DSC 분석법에는 장점과 단점이 존재하는데, 이를 아래의 표로 정리했다.
|
장점 |
단점 |
|
1. 열량을 직접적으로 측정하므로 속도가 빠름 2. 시료 사용량의 단위가 작음 3. 온도 변화를 즉각적으로 측정 가능하며 안정적 4. Pt를 sensor로 이용하여 높은 선형성을 보이며 보정이 쉬움 |
1. 가열기-sensor를 연결하는 전선이 외부에 노출되어 오염에 취약함 2. 가열로의 수리가 불가능하여 고장 시 직접 교체 필요 3. 내구성 약함 4. 사용할 수 있는 온도의 폭이 좁음 |
② 열 흐름 DSC (Heat Flux DSC 이하 HF-DSC)

HF-DSC는 PC-DSC와는 다르게 하나의 열원으로부터 시료와 reference가 같이 가열된다. 그리고 두 물질 사이의 온도 차이가 감지 sensor에 의하여 감지된다. 그리고 시료-reference 온도 차이가 발생하더라도 단순한 온도의 차이만 감지될 뿐 열 변화를 보상하기 위한 에너지 흐름은 발생하지 않는다. 즉, 단순한 온도 차이가 열량의 차이로 해석되어 결과값을 얻기 때문에 DTA의 원리와 비슷하다. HF-DSC에서는 여러 열적 정보(시료 및 장치의 열전도도, 열용량 등)의 영향이 존재하기 때문에 이를 보정을 해야 정확한 데이터를 얻을 수 있다. HF-DSC도 마찬가지로 장단점이 존재하며, 아래의 표에 정리하였다.
|
장점 |
단점 |
|
1. 시료가 열분해, 가스 발생 등과 같은 오염에 강함 2. 가열로의 수명이 긺 3. 가동할 수 있는 온도의 범위가 넓음 |
1. 전압의 변화가 온도의 변화보다 작아 오차가 크게 발생하며, 선형성이 나쁨 2. 열에 대한 정보를 잘 감지하지 못하고 열량 계산이 힘듦 3. 등온, 급격한 냉동에 취약 4. 분해능이 낮음 |
③ DSC 측정 시 필요한 조건 및 유의사항
ⅰ) 시료의 형태 - 파우더, 필름, 칩, 슬러리, 겔, 용액 등 다양한 형태로 이용 가능하다.
ⅱ) 시료의 중량 - sample의 양이 적은 것이 여러 변수를 고려했을 때 실험을 진행하기 편하다.
ⅲ) 시료 packing - 시료와 plate 사이의 접촉을 최대로 하는 것이 좋기 때문에 균일하게 채운다.
ⅳ) 승온 속도 - 승온 속도는 분해능. 전이 온도, peak에 영향을 미치기 때문에 적절히 고려하여 설정한다.
ⅴ) 측정 환경 - 열에 대한 안정성을 요구하므로 질소, 헬륨을 주로 사용한다.
4) DSC의 결과 분석
DSC를 통해 얻은 그래프는 heat flow를 표현하나 엔탈피의 정의에 따라서 ∆H=q 라고 생각할 수 있다. 이 사실을 바탕으로 고분자 시료에 대한 여러 물리량들을 분석할 수 있다. 일반적으로는 DSC 분석 결과로 얻은 그래프와 base line 사이의 넓이를 이용하여 값을 구한다.

m×∆Hm=k×A
m : 시료의 질량, ∆Hm : 단위질량당 엔탈피 변화, k : 기기 별 상수, A : base line - peak 면적
그리고 이 특성을 이용하면 고분자가 가열에 의해 보이는 물리량들을 측정할 수 있다.
① 흡열 반응 및 발열 반응
흡열 반응은 base line을 기준으로 peak가 위로, 즉 위로 볼록한 그래프가 관찰될 때 해당 구간에서 흡열 반응이 진행되었다고 한다. 이는 흡열 반응에서 엔탈피 변화량이 양수 값을 갖기 때문이다. 반대로 발열 반응은 base line을 기준으로 peak가 아래로 형성되어 아래로 볼록한 그래프가 관찰되는 구간에서의 반응을 말한다. 발열 반응에서는 엔탈피의 변화량이 음수 값을 갖기 때문이다.
② 유리 전이 온도
|
그림 SEQ 그림 \* ARABIC 6 유리 전이 온도 구하기 |
유리 전이 온도 이전의 base line과 유리 전이 온도 이후의 base line을 기준으로 해당 구간에서 maximum slope를 갖는 직선을 그어 onset, end point를 구한다. 두 지점의 평균 온도를 유리 전이 온도로 그어 생각할 수 있다.
③ 결정화 온도 및 결정화도(crystallinity)
그림 SEQ 그림 \* ARABIC 7 결정화 온도 및 결정화도 그래프
결정화 온도는 peak가 최대로 나타나는 지점의 온도를 말한다. 한편, 결정화도는 결정성 고분자가 어느 정도로 결정화가 되었는지 확인할 수 있다. 이는 해당 peak를 포함하는 구간에 base line을 긋고 결정화도를 생각할 수 있다.
crystallinity=∆H∆H at 100%
위의 식에서 ∆H 는 base line - peak의 넓이이며, ∆H at 100% 은 Polymer Data handbook을 기준으로 한 α-crystalline material의 엔탈피 변화량이다.
④ 용융 온도
그림 SEQ 그림 \* ARABIC 8 용융 온도 그래프
고분자의 특성을 설명에서 말했듯이, 유리 전이 상태와 결정 상태를 거쳐 결정이 모두 사라질 때 까지의 온도를 용융 온도라고 한다. 이 부분도 그래프의 peak가 나타나는 부분을 용융 온도로 정의한다.
⑤ 열용량 Cp
열용량은 시료의 온도를 1℃ 또는 1K를 올리는데 필요한 열량을 의미한다. 단위는 JK-1 이다. DSC 결과 분석에서는 결과로 관찰된 heat flow와 승온 온도를 이용하면 열 용량을 구할 수 있다.
heat flow Q=Qt
heating rate T= ∆Tt
heat capacity Cp=Q∆T=Q/t∆T/t=QT
'자료.zip > 화공생명공학전공실험' 카테고리의 다른 글
| PCR + 전기영동 (0) | 2021.02.01 |
|---|---|
| FT-IR 분석 실험 (0) | 2021.02.01 |
| 접촉각 측정 (Contact Angle) (1) | 2020.12.17 |
| Grignard Reagent를 이용한 Triphenylmethanol synthesis 실험 (0) | 2020.10.28 |
| 증기압측정 (0) | 2020.09.26 |