
Ⅳ. Procedure
1. KBr과 사용할 시료를 100:1의 비율로 혼합한 후 막자사발에서 갈아 미세한 가루로 만든다. 충분한 시간을 들여 갈아준다.
2. Pelletizing by Pelletizer
- 희석한 sample을 아래 pelletizer 바닥을 가릴 정도로 넣은 다음 힘으로 세게 5~8분 동안 압력을 걸어주어 pellet을 만든다
3. Sampling setting
- pellet을 back plate의 원에 위치하도록 놓고 고정한다. 이 sample을 FT-IR 시료실내의 sample holder의 고정판 홈에 끼워 놓고 뚜껑을 닫는다
4. Sample을 scan하고 나온 스펙트럼을 저장한다.
<주의사항>
1. 실험실 내 음식물 반입 금지
2. 실험 시 장갑 착용
3. 시약과 호흡기 사이의 거리 유지
4. 뒷정리
Ⅴ. Data & Result
1. IR spectrum & structure



2. Spectrum analysis
1) biphenol A
3500-3200 O-H alcohols & phenols
3100-3000 C-H aromatics
3000-2850 C-H alkanes
1680-1640 C=C alkene
1600-1585 C-C aromatics
1400~1500 C=C aromatic
1375~1450: CH3 methyl
1320-1000 C-O alcohol, carboxylic acid, ester, ether
900-690 C-H aromatics
650 이하 etc
2) benzoic acid
3500-3200 O-H alcohols & phenols
3100-3000 C-H aromatics
3000-2600 O-H alcohols & phenols
1760-1690 C=O carboxylic acid
1600-1585 C-C aromatics
1320-1000 C-O alcohols, carboxylic acid, esters, ethers
950-910 O-H carboxylic acid
900-690 C-H aromatics
650이하 etc
3) 미지시료
3500-3200 O-H alcohols & phenols
3400-3250 N-H 1° 2°amines, amides
2950-2850 C-H aromatics alkanes
2500-2300 O-H carboxylic acid
1700-1500 C=O ketone carboxylic acid
1300-1200 C-O
1300-1200 C-N amines
1200-1000 C-O alcohols, carboxylic acid, esters, ethers
900-690 C-H aromatics alkane
650 이하 etc
위의 미지시료를 통해서 아래의 2가지 구조를 생각해볼 수 있다.
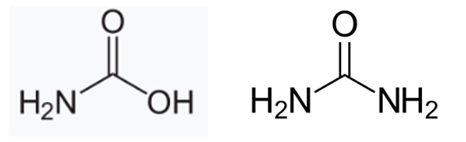
Ⅵ. Discussion
FT-IR을 통해서 biphenol A와 benzoic acid를 분석해보고 이를 바탕으로 미지 시료의 구조를 추론해보았다. 이를 위해서 우선 baseline으로 사용할 KBr sample에 대한 IR부터 측정을 했다. KBr은 IR 실험 결과에 큰 영향을 미치지 않는데, 대부분의 자외선과 적외선을 투과하기 때문이다. 다만, 공기의 영향을 최대한 배제하기 위해서 압력을 가한 시료를 사용했다. 다만, KBr은 물을 잘 흡수하는 성질을 갖고 있기 때문에 공기중에 최대한 노출이 되지 않도록 주의해야 한다. 만약 KBr이 충분한 수분을 흡수했다면 IR spectrum에서 3000-3500부근에서 peak가 나타날 것이다. KBr background scan의 목적은 실험 환경을 IR로 측정하고 이를 분석하고자 하는 sample들에 보정을 해주는 역할을 한다. biphenyl A와 carboxylic acid를 분석해본 것을 바탕으로 미지시료의 구조를 추론할 수 있었다. 만약 탄소가 2개 이상이었다면 관찰된 aromatic peak를 이용해서 고리구조를 가지며 질소를 포함하고 있는 물질에 대해서 생각해보았을 것이다. 하지만 탄소의 개수가 하나였으므로 해당되지 않는다. 그리고 3500-300부근에서 발견된 넓은 peak를 보는 관점에 따라서 2가지 분자구조를 생각해볼 수 있다. 만약 해당 peak가 잘못된 KBr 처리로 수분이 포함되었는 상태로 측정을 했다면 시료에는 OH가 포함되지 않아야 하며, 요소로 생각해볼 수 있다. 하지만 시료에도 OH가 포함되었다고 생각을 해보면 아민과 카르복실산을 동시에 포함하며 탄소가 하나인 carbamic acid로 생각해볼 수 있었다. 이 두 구조 모두 packing이 잘 되어 분자상의 CO2가 분석에 관여하지 못했다는 것을 가정한 후 추론한 것이다.
최대한 정확한 결과를 얻고자 했지만 그럼에도 불구하고 다음가 같은 이유로 정확한 spectrum을 얻지 못했다. 우선 pellet을 만들 때 공기중의 산소, 수소, 이산화탄소 등을 제거하기 위해 압력을 가한다. 하지만 pressure를 손으로 가하기 때문에 완전히 공기가 제거되지 못했을 수 있으며 이는 추가적인 peak가 관찰되는데 영향을 줄 수 있다. 또한 시료를 가는데 사용하는 막사사발과 국자를 과정마다 세척을 하고 진행하고자 했다. 하지만 사발에 흠집이 많이 있었고, 해당 부분으로 시료가 손실이 되거나 기존에 축적되었던 물질이 묻어나올 수 있기 때문에 스펙트럼에 영향을 줄 수 있다. 그리고 peak의 정보들만 가지고 판단을 진행하는데, 실험자가 직접 예측을 하는 것이므로 미지시료가 정확하지 못할 수 있다. 그리고 KBr과 시료를 섞어서 사용하며 시료의 양이 매우 적으므로 만약 혼합물 추출 시 운이 나쁘다면 분석이 잘 이루어지지 않을 수 있다.
Ⅰ. Theory
Fourier Transform Infrared Spectroscopy (FT-IR)
Ⅱ. Purpose
FT-IR의 작동 원리를 이해하고 solid 형태의 물질에 대한 시료 준비 방법과 그에 대한 실험결과를 분석하고자 한다.
1. 대표적인 작용기를 갖는 물질들의 FT-IR spectrum을 통해서 peak를 확인
2. 미지 시료의 spectrum 분석을 통해 어떤 구조의 물질일지 추측
Ⅲ. Theory
1. 전자기 스펙트럼의 특성과 에너지
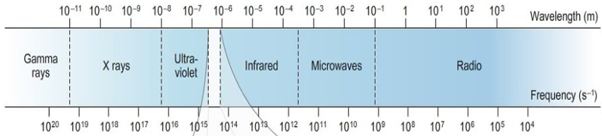
전자기파는 파동이 갖는 에너지에 따라 달라진다. 전자기파의 에너지는 진동수에 의해 결정되고 다음 식이 성립한다.

또한 파동의 속력이 일정할 때 파동의 진동수와 파장은 반비례 관계에 놓인다. 빛과 같은 파동은 속력이 일정하기 때문에 진동수와 파장의 곱은 항상 일정하다. 이 관계를 식으로 표현할 수 있다.

두 식을 정리하면 진동수가 빠를수록, 파장이 짧을수록 에너지가 더 크다는 것을 알 수 있다. 적외선은 780nm~1000μm의 파장 범위를 보이며 비교적 긴 파장을 갖는다. 즉, 적외선은 비교적 낮은 에너지를 갖는다.
2. 분광학에서의 에너지 준위와 에너지 전이
분광학에서는 시료에 빛을 쏘며, 물질은 특정 파동을 흡수 및 방출할 수 있으므로 에너지 변화가 수반된다. 에너지는 양자화 되어있어 두 상태의 에너지 차이와 같은 에너지에 의해서만 전이가 진행된다. 어떤 분자의 전체 에너지는 다음과 같이 4가지 형태의 에너지의 합으로 표현된다.

다만, 분광학에서 시료는 고정되어 있기 때문에 회전 운동 에너지($E_{rot}$)와 병진운동 에너지($E_{trans}$)의 효과는 무시된다. 즉, 에너지의 변화는 전자에너지의 변화 혹은 진동 에너지의 변화에 의해서만 발생할 수 있다. 시료가 빛을 흡수하면 다음과 같이 에너지 전이가 발생할 수 있으며, 그 크기는 다음과 같다.
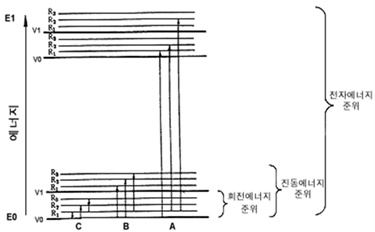

한편, 앞서 말했듯이 시료는 빛을 받으면 에너지 전이가 발생한다. UV-Vis 분광학에서 사용하는 광원은 높은 에너지를 갖고 있기 때문에 전자에너지 준위 수준에서의 전이가 발생할 수 있다. 하지만, FT-IR 분광학에서 사용하는 광원처럼 낮은 에너지를 갖고 있는 경우에는 전자 에너지를 변화시킬 수 없으며 진동에너지 혹은 회전에너지에만 변화를 줄 수 있다. 다만, 분광분석시 회전 운동의 변화는 거의 발생하지 않으므로 진동 에너지의 변화가 발생할 수 있다. 한편, 모든 진동에너지가 적외선을 흡수할 수 있는 것은 아니다. 진동 및 회전 에너지에 의해서 Dipole moment(D)가 변화하는 경우에만 적외선을 흡수할 수 있다. IR을 흡수할 수 있으면 이 물질은 IR active하다고 하며, 흡수하지 못하는 경우에는 IR inactive하다고 말한다. 예를 들면 극성 분자는 진동 및 회전에 의해서 거의 D가 변하므로 IR active하다. 반면, H2, O2, Cl2와 같은 무극성 분자들은 운동에 의해서 D가 거의 변하지 않으므로 IR inactive하다.
3. 분자 진동의 종류
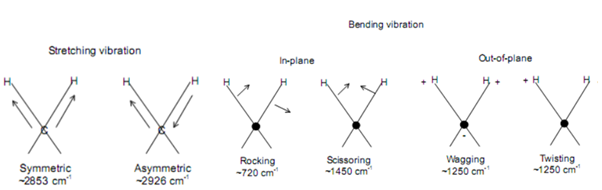
분자는 온도에 관계없이 항상 진동운동을 할 수 있다. 다만, 결합의 길이가 변하는가, 결합의 각도가 변하는지에 2가지 기준에 따라 분류된다. 결합의 길이가 변하는 진동 운동을 Stretching vibration이라고 한다. 만약 결합의 길이가 대칭적으로 변한다면 Symmetric stretching이라고 하며, 그렇지 못한 경우에는 Asymmetric stretching이라고 한다. 또한 결합각이 변하는 진동 운동을 Bending vibration이라고 한다. 그 중에서도 각도의 변화가 한 평면 위에서 진행될 수도 있으며, 그렇지 않을 수도 있다. In plane일 때, 결합이 같은 방향으로 움직인다면 이를 rocking bending, 반대 방향으로 움직인다면 scissoring bending이라고 한다. 그리고 Out of plane일 때, 같은 방향으로 결합이 이동한다면 wagging bending, 반대 방향으로 움직인다면 twisting bending이라고 한다.
4. 화학결합에서의 hook’s law와 진동에너지의 전이
앞서 말했듯이 적외선 영역의 전자기파는 화합물의 전자를 들뜨게 하지 못하고 화합물들을 진동 및 수축하게 만들 수 있다. 분자에서의 진동 및 수축은 용수철에서의 진동 및 수축의 연장선이라고 생각할 수 있다. 이를 이용해서 진동에너지 전이 개념에 대해 이해하려면 몇가지 개념을 먼저 알아야 한다.
1) 용수철에서의 hook’s law

용수철에서 평형을 이루고 있을 때보다 만큼 변하면 이에 저항하는 탄성력이 발생한다. 이 힘의 크기는 다음 관계를 갖는다.
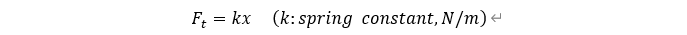
한편, 해당 평형 상태에 대해서 거리가 r만큼 변하면 다시 평형점으로 돌아오게 하려는 구심력이 존재하고, 이 힘은 아래의 관계를 갖는다.

이 system에서는 이며 이기 때문에 식을 정리할 수 있으며 각속력과 진동수 사이의 관계 를 이용하면 식을 정리할 수 있다.

2) reduced mass μ
물리계에서는 두 물체 사이의 상호작용에 대해서 논의하는 경우가 많다. 하지만, 두 물체에 대해서 동시에 고려를 하게 되면 어려움이 발생하기 때문에 한 물질에 대한 상대 물질의 거동성으로 물질을 표현할 수 있다. (질량 중심에 대해서 논의하는 것도 이와 비슷한 원리이다.) 이는 뉴턴의 제 2법칙 (힘과 가속도 사이의 관계) 및 뉴턴의 제 3법칙(작용-반작용)을 이용하면 구할 수 있으며, 이를 통해 나온 환산 질량 (reduced mass, )는 다음과 같다.
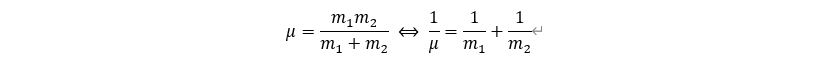
3) 양자화된 에너지
양자화학에서의 Born-Interpretation을 따르면, 파동함수는 확률로 해석된다. 그래서 파동함수와 그 함수의 conjugation을 곱한 함수는 정규분포 곡선을 따르며 적분이 가능해야 하고 그 값은 1이여야 한다. 또한 파동함수는 one to one 함수이며, 슈뢰딩거방정식의 해이다. 또한, Hermitian operator를 이용하면 파동 함수의 오목 볼록 여부를 결정할 수 있다. 한편, Hermitian operator는 eigenfunction으로 파동함수를 가지며, eigenvalue로 에너지 E를 갖는다. 이들을 고려하면 파동함수는 에너지 함수가 closed-boundary condition에 놓여있을 때 eigenvalue E에 의하여 에너지가 양자화된 형태로 존재할 수 있다. 이를 보고 에너지가 ‘양자화’되어 있다고 할 수 있다.
4) 화학결합에서의 hook’s law
가장 고려하기 쉬운 분자인 HCl에 대해 논의해보자. 분자가 가장 안정한 상태에 놓일 때 갖는 화학 결합의 길이를 req 라고 하자. 하지만, 분자는 3에서 이야기했던 것처럼 진동운동을 할 수 있으며, 핵간 사이의 거리가 변할 수 있다. 이를 hook’s law에 적용하면 아래와 같이 힘과 탄성에 의한 위치 에너지를 표현할 수 있다.


한편, HCl은 원자 H와 Cl에 개입하는 힘이 F 가 유일하다고 하면, 이 system은 조화 진동자에 놓인다. 그렇기에 두 원자 사이의 상호작용으로 운동을 설명할 수 있는데, Cl의 크기 및 질량이 H에 비해 월등히 높기 때문에 Cl이 고정되어 있다고 생각하고 H의 상대적인 움직임에 대해 살펴보자.
분자가 조화진동자를 따를 때 진동수는 다음과 같이 표현할 수 있다.

위의 그림과 같이 Cl을 고정하고 H에 대한 움직임을 판단할 수 있으므로, 즉 Cl을 벽에 고정하고 벽에 둔 조화 진동자 모델로 해석하는 것이다.
한편, 적외선 분광 분석에서는 에너지의 척도로 파수(wave number)를 이용한다. 이 척도의 단위는 cm−1를 이용한다. 에너지와 진동수는 비례관계이기 때문에 식을 적절하게 변환하면 위의 식을 파수에 대해서 표현할 수 있다.

5) 조화진동자의 양자화된 에너지 준위
분자의 진동이 조화진동자를 따를 때 진동 양자수 v 를 이용하면 양자화된 에너지 준위를 표현할 수 있다.

그리고 적외선 분광 분석에서 사용되는 wave number의 단위로 변환하기 위해서 위의 식을 변환할 수 있다.
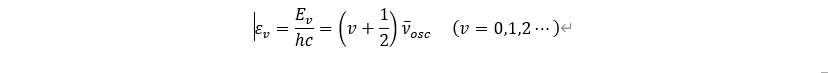

진동 양자수에 따라서 에너지들이 정의되며, 위의 그림에서 Harmonics 곡선을 따른다. 진동 양자수 v=0, 1, 2⋯ 대입하면 εv=12νosc, 32νosc, 52νosc ⋯ 이다. 이를 통해서 2가지 중요한 사실을 발견할 수 있다. 첫 번째로 에너지가 가장 낮은 지점의 에너지가 0이 아니기 때문에 진동에 의한 에너지는 절대온도가 0K인 지점에서도 항상 관찰된다. 그리고 진동 에너지 준위의 차이는 νosc 로 일정하다. 따라서 한 분자에 계속해서 적외선을 비추었을 때 나타나는 흡수 스펙트럼의 wave number는 배수 관계를 갖는다. 하지만, 실제로는 분자들이 단순 조화 운동을 하지 않기 때문에 modeling 한 에너지함수를 따르지 않는다. 이 이유에 대해서 살펴보도록 하자.
6) 실제 분자에서의 진동 에너지 양자화 현상
위의 그림에서 나타나는 Morse 그래프는 조화진동자 모델을 이용한 위치에너지보다는 비교적 정확하게 분자 진동 에너지를 설명할 수 있다. 이처럼 이상적 모델과 실제 분자가 다른 에너지 경향성을 보이는 이유는 현실세계에서의 결합 거리가 갖는 의미를 살펴봐야 알 수 있다. 어떤 두 원자가 결합을 하기 위한 필요조건은 두 원자가 일정 거리 내로 다가와야 한다는 것이다. 즉, 원자 사이의 거리가 너무 멀어지면 그 분자는 결합을 유지하지 못하고 해리된다. 결합의 길이가 req 로 가장 안정할 때를 기준으로 해리될 때 필요한 에너지를 Deq 라고 한다. 진동의 비조화성을 이용하면 에너지를 구하는 모스 함수(Morse function)를 얻을 수 있다.

이 식에서 값은 분자의 종류에 따라서 달라지는 상수이다. 모스 함수로부터 마찬가지로 양자화된 에너지를 wave number의 단위로 표현할 수 있으며 그 에너지는 아래와 같다.

여기서 는 평형상태에서의 진동 wave number이며, 는 분자마다 보이는 비조화 상수이나, 일반적인 값은 0.01이다.

위의 그림을 다시 살펴보자. 모스 함수를 사용하더라도 에너지의 최솟값이 0보다 크다. 이를 따라서 해리될 때 에너지와 최저점의 에너지를 가질 때의 에너지 차이, 즉 실제로 분자가 해리하기 위해서 필요한 에너지를 새롭게 정의하고, 이를 라고 하자. 조화 진동자를 따르는 에너지 함수는 진동 양자수가 증가하더라도 그 에너지 간격이 일정했다. 하지만, Morse함수를 따르는 에너지 함수에서는 진동 양자수가 증가하면 진동 에너지 전이 간격이 짧아지는 것을 확인할 수 있다. 실제로 식에 진동 양자수를 대입해본 후 에너지 차이를 구해봐도 그 값이 감소하는 것을 알 수 있다. 원칙적으로는 큰 값의 진동 양자수를 넣을 때에는 비조화 상수를 뿐만 아니라 등 추가적인 상수들을 고려해야 한다. 다만, 우리는 낮은 진동 양자수를 가질 때의 에너지 현상을 관찰할 것이므로 만 이용해서 표현하도록 하겠다.
8) 실제 분자에서의 진동 에너지 전이와 흡광 정도의 예측
비조화 진동자에서 선택규칙(selection rule)을 따라 에너지 전이가 발생한다면 진동 양자수의 변화 정도는 정수를 따른다. (∆v=±1, ±2, ±3⋯) 다만, time-dependent 슈뢰딩거 방정식을 풀어주면 이원자 분자는 전자기파에 의하여 진동 양자수의 변화량이 1인 지점까지의 전이가 가장 활발하게 일어나는 것을 알 수 있다. ∆v=±1인 지점에서 활발 그리고 ∆v 이 커질수록 선택규칙을 만족하는 진동 에너지 전이가 발생하더라도 흡광도가 현저히 떨어진다.
9) 기준 진동 방식과 IR spectrum에서의 peak 개수
우리가 실제로 IR을 이용해서 분석하고자 하는 물질은 유기물 등 3개 이상의 원자를 갖는 경우가 대부분이다. 이는 실제 IR을 사용해 spectrum을 얻으면 peak의 개수가 2개 이상일 수 있음을 시사한다. 다원자 분자는 3차원 상에 위치하며, 각 좌표는 한 원자에 대해서 하나의 자유도를 갖는다. 그렇기 때문에 분자를 구성하는 원자의 개수 n 에 대해서 분자가 보일 수 있는 운동의 종류는 3n 이다. 다만, 병진 운동 에너지와 회전 운동에 의한 자유도를 제외하면 기본 진동 방식에 따른 peak의 개수를 유추할 수 있다. 비선형 다원자 분자의 경우에는 기본 진동 방식이 3n-6 , 선형 다원자 분자는 3n-5 의 기본 진동 방식을 보인다고 해석한다.
5. Infrared Spectroscopy (IR-Spectroscopy)
Theory 1~4에서 이야기했던 내용을 기반으로 적외선 분광 분석을 설명할 수 있다. IR Spectroscopy는 중간영역의 적외선을 광원으로 하여 시료를 분석하는 분광 분석법을 말한다. 적외선 영역의 전자기파는 화합물들을 진동 및 수축하게 만들 수 있으며, 그 에너지 값은 어느 정도 정해져 있다. 그래서 IR 분광법은 어떤 분자가 갖고 있는 작용기를 파악하거나, 정보가 어느정도 제공이 되어 있을 때 분자 구조를 결정하기 위해서 사용한다. 또한 특정 영역의 wave number는 지문 영역이라고 하여 해당 영역에서 보이는 peak의 여부가 시료의 종류를 결정지을 수 있다.
1) 구성
일반적인 분광 분석기처럼 IR Spectroscopy도 광원->간섭계->시료->검출기 과정을 거쳐 정보가 처리된다.

FT-IR 분광 분석기는 빛을 두 갈래로 나누어 시료에 쏘아, 그 정도를 판단해서 interferogram을 얻는다. 그리고 Fast Fourier Transform(FFT)를 이용하여 optical path difference를 축으로 가졌던 그래프에서 우리가 분석하고자 했던 wavenumber를 갖는 흡수 스펙트럼을 얻을 수 있다. 그리고 단순히 한 번의 분석을 하는 것이 아니라, 우리가 얻게 되는 흡수 스펙트럼은 상대적인 값으로 주어진다. 이는 시료가 존재할 때 발생한 흡광도를 시료가 분석하고자 하는 시료가 없을 때의 비율을 얻는다. 빛, 공기중의 수증기 등 적외선에 흡수가 될 수 있는 가능성이 많기 때문이다.
2) 특징적인 IR peak와 IR peak의 개수
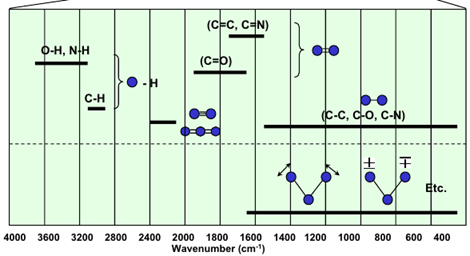
IR을 이용해서 정성적인 결과, 즉 분자구조 등을 추론하기 위해서는 특정 화학결합은 특정 에너지 범위 내에서 peak 값을 보인다는 것을 이해해야 한다. 이 peak에서 범주를 나눌 때 수소와의 결합, 삼중결합, 이중결합, 그리고 단일 결합 영역으로 분리하여 생각할 수 있다.
① 수소와의 결합
| 수소와의 결합 | |||
| 결합의 종류 | O-H | N-H | C-H |
| 결합의 세기 (kcal) | 120 | 108 | 105 |
| 파수 (cm−1) | 3600-3500, 3500-3000 | 3400-3300 | 3200-2900 |
수소와의 결합은은 IR spectrum에서 비교적 높은 에너지를 갖는다. 그래서 파수가 높게 측정되며 크기는 O-H, N-H, C-H 순으로 크다. 한편, O-H는 수소결합을 보이는 대표적인 원자단으로 분석하고자 하는 시료 사이에서 강력한 수소결합을 보이며, 이는 peak의 모양에 큰 영향을 준다. 일반적인 spectrum에서 보여지는 peak와 달리 O-H에 의한 peak는 넓은 형태로 관찰된다. 즉, 높은 파수의 영역에서 범위가 넓은 peak의 유무는 O-H 원자단의 유무를 결정지을 수 있다.
② 다중결합의 IR Spectrum
삼중결합에 대해서는 두가지 종류 C≡O , C≡N 에 대해서만 고려한다. C≡N 결합의 세기가 더 크기 때문에 흡수 시 더 많은 에너지가 필요하며, 더 높은 파수에서 관찰된다. 다만, IR spectrum에서 다중결합 중 이중결합이 삼중결합보다 더 중요하다. 이중결합은 보통 C=O 와 C=C 에 대해 살펴본다. C=O 결합의 peak는 1700 wavenumber보다 더 큰 영역에서 관찰된다. 그리고 C=C 의 경우 1650 wavenumber 근처에서 발견된다. 하지만, C=C 의 peak는 시료의 구조에 따라서 1700보다 약간 적은 위치에서 발견되기도 한다. 앞서 살펴봤듯이 진동에너지는 분자의 질량 또는 결합의 세기에 의해 결정된다. 다만, 원자의 질량에 차이는 거의 없으므로 결합의 세기에 의해 차이가 발생한다고 생각할 수 있다. conjugation이 있는 분자 구조에서는 공명구조가 관찰된다. 탄소사이의 단일결합과 이중결합 사이의 공명이 발생하면 해당 결합은 1.x 결합으로 해석된다. 즉, C=C 에 의해 예상되던 이중결합보다 더 작은 결합세기를 가지므로 1700보다 더 낮은 영역에서 peak가 관찰될 수 있음을 알 수 있다.
③ IR peak의 개수
Theory 4-9에서 살펴본 것처럼 기준 진동 방식에 따라 예측되는 peak의 개수와는 다르게 측정되는 경우가 많다. 기준 진동 방식을 이용해서 예상한 peak 보다 그 개수가 많은 경우와 적은 경우에 대해 아래에 정리했다.
ⅰ) 예측한 수보다 더 적은 수의 peak
- 분자가 대칭적인 움직임을 보일 때
- 분자가 보이는 총 진동 에너지의 종류 중 몇가지의 진동에너지가 비슷한 에너지를 보일 때
- 흡수의 세기가 매우 낮아 관측이 안될 때
- 진동 에너지의 크기가 실험에 사용하는 기기의 관측 가능한 범위 박의 값을 가질 때
ⅱ) 예측한 수보다 더 많은 수의 peak
- 선택전이 뿐만 아닌 진동 양자수의 변화의 크기가 2이상일 때
- 특정 에너지가 2가지 진동 방식의 에너지에 변화를 일으킬 때
Ⅶ. Reference
1. 서강대학교 화공생명공학기초실험1 매뉴얼 2020
2. FTIR Seminar, Jasco
3. 분광학의 기초: 이론, Agilent Technologies, 2016
'자료.zip > 화공생명공학전공실험' 카테고리의 다른 글
| Hplc (1) | 2021.02.01 |
|---|---|
| PCR + 전기영동 (0) | 2021.02.01 |
| 접촉각 측정 (Contact Angle) (1) | 2020.12.17 |
| Grignard Reagent를 이용한 Triphenylmethanol synthesis 실험 (0) | 2020.10.28 |
| 증기압측정 (0) | 2020.09.26 |