
Contents
1. Joule의 실험과 그 의의 (Joule's Experiment and its meaning)
2. 내부 에너지의 구성 (Composition of Internal Energy)
3. 분자 관점에서의 내부 에너지 (Molecular Interpretation of Internal Energy)
4. 내부에너지의 특성 (Properties of Internal Energy)
1. Joule의 실험과 그 의의 (Joule's Experiment and its meaning)
열역학을 이야기하려면 Joule을 빼놓고 이야기할 수 없습니다. 그가 밝힌 여러 중요한 사실이 있으나, 잘 알려져 있는 줄의 실험 (Joule's Experiment)에 대해 알아보겠습니다.
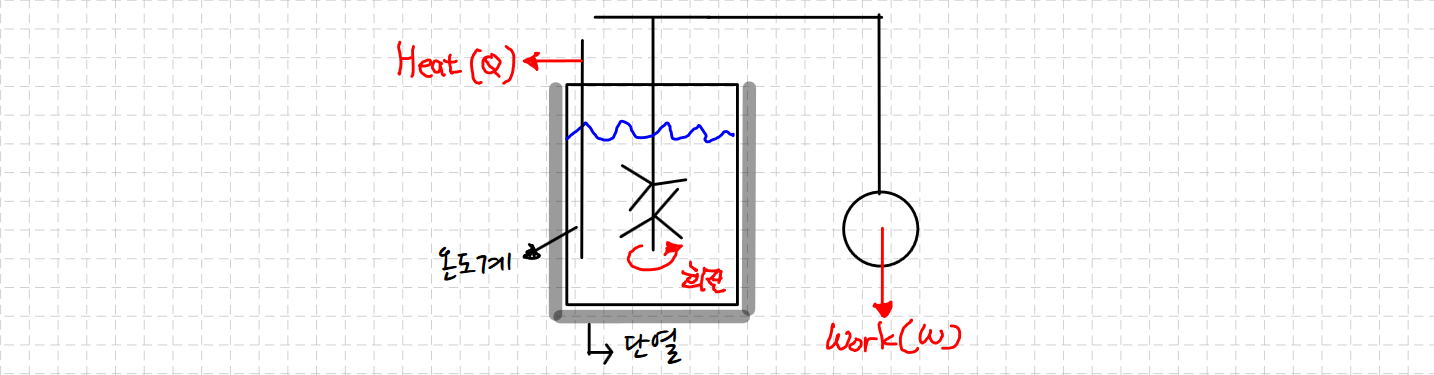
실험 원리는 다음과 같습니다.
- 단열된 용기에 액체를 넣어 실험 외 요인이 온도에 영향을 미치지 못하도록 합니다.
- 추의 위치에너지를 조정하면서 연결되어 있는 교반기가 용기에 담겨있는 액체에 일을 가할 수 있도록 합니다.
- 어느 정도의 교반 후 온도를 측정하여 일의 영향을 확인해봅니다. 그 결과 온도가 어느정도 상승한 것을 알 수 있었습니다.
Joule은 위의 실험을 통해서 일과 열 사이에는 정량적 관계가 있으며, 일도 에너지의 한 형태라는 것을 밝혀냈습니다.
이 주장이 성립되려면 교반된 물이 열을 발생시키는 존재에 대해 설명할 필요가 있었습니다. 해당 존재를 가시적으로 관찰하기는 힘들었으나, 물 내부에 영향을 주는 어떠한 존재가 분명 존재했기에, 이를 내부에너지(Internal Energy, U)라고 정의하게 됩니다.
2. 내부에너지의 구성 (Composition of Internal Energy)
1) 내부에너지를 설명할 때 고려하는 점
내부에너지를 설명할 때는 물질 자체가 갖고 있는 에너지에 대해서만 설명을 하려 합니다. 그렇기 때문에 설명하는 물질의 거시적 운동, 즉 운동 에너지와 위치 에너지를 고려하지 않습니다.
(i.e. 물질을 보관하고 있는 용기가 움직이지 않는 상황에 대해서 이야기합니다.)
2) 내부에너지를 구성하는 에너지
분자들은 끊임없이 움직입니다. 그렇기에 복잡한 거동을 보이는데, 이는 몇가지 특정한 움직임들의 조합으로 관찰된다는 것을 알아냈습니다.
(1) 병진운동에너지 ($E_{trans}$) : 분자가 직선운동하여 갖는 운동에너지를 의미합니다.
(2) 회전운동에너지 ($E_{rot}$) : 다원자분자는 자체적인 축을 따라 회전할 수 있는데, 이때 발생하는 회전운동 에너지$^{[1]}$를 의미합니다.
(3) 진동운동에너지 ($E_{vib}$) : 화학결합은 고정되어 있지 않고 항상 움직입니다. 그렇기에 화학결합을 이루고 있는 원자들은 항상 움직이게 되는데, 이 움직임으로 인해 발생하는 에너지를 진동운동에너지라고 합니다. 진동운동에너지의 경우는 절대온도 0K 에서도 존재합니다.
3. 분자 관점에서의 내부 에너지 (Molecular Interpretation of Internal Energy) : 등분배정리 (Equipartition Theorem)
내부에너지를 정량적으로 계산하고자 하는 연구가 진행되었으며, 통계열역학(Stastical Thermodynamics)을 기반으로 한 등분배정리(Equipartition Theorem)은 이를 가능하게 했습니다.
등분배정리는 다음과 같습니다.
모든 종류의 분자는 자유도 n을 가지고 있으며, 각 자유도는 $\frac{1}{2}k_{B}T$의 에너지를 갖고 있습니다. 특정 분자는 $T=0 K$가 아닌 지점에서 $\frac{n}{2}k_{B}T$를 내부에너지로 갖고 있습니다. ($k_{B}$ : Boltzman's Constant, $T$ : 온도)
자유도는 분자가 에너지를 저장하는 방법의 종류를 나타냅니다. 병진/회전/진동 운동에너지가 분자에 저장되어 있는 방법의 수를 의미합니다.
등분배정리를 쉽게 이해하기 위해서 이상기체 중에서 대표적인 예시를 살펴보겠습니다.
Example (for ideal gas)
(1) 단원자분자 ($He, Ne$ 등)
단원자분자는 직선운동만 할 수 있습니다. x,y 그리고 z축으로의 병진운동에너지를 포함할 수 있기 때문에 단원자분자의 자유도 n = 3입니다. 따라서 자유에너지는 다음과 같습니다.
$U(T) = U(0K) + \frac{3}{2}k_{B}T\Rightarrow \Delta U = \frac{3}{2}k_{B}T$ (1)
(2) 직선형분자 ($O_2, N_2$ 등)
직선형 분자는 직선운동과 회전운동 에너지를 갖고 있습니다. 다만 회전운동에서 x, y, z축 중 한 방향에 대해서는 회전운동 에너지가 나타나지 않습니다. 따라서 자유도 n= 5이며, 내부에너지는 다음과 같이 나타납니다.
$U(T) = U(0K) + \frac{5}{2}k_{B}T\Rightarrow \Delta U = \frac{5}{2}k_{B}T$ (2)
(3) 다원자분자 ($CH_4$ 등)
다원자분자는 직선운동, 회전운동 뿐 아니라 진동운동 등 다양한 에너지를 갖고 있기 때문에 자유도 n이 완전한 정수로 표현되지 않습니다.
4. 내부에너지의 특성 (Properties of Internal Energy)
내부에너지는 몇가지 특성을 갖고 있습니다.
1) 내부에너지는 '변화량'만 측정 가능하다.
내부에너지의 원론적인(primitive) 개념이기에 절대값을 알기 힘듭니다. 그렇기에 내부에너지의 측정은 반드시 초기 온도에서의 내부에너지로부터 얼마나 변화했는지만을 측정할 수 있습니다.$^{[2]}$ 예를 들어 상온에 있던 물질에 대한 내부에너지의 변화량은 아래와 같이 표현됩니다.
$U(T) = U(298.15K) + \frac{n}{2}k_{B}T\Rightarrow \Delta U = \frac{n}{2}k_{B}T$ (3)
2) '이상기체'의 내부에너지는 온도에 의존한다.[3]
내부에너지가 식 (3)처럼 표현되는 것을 볼 수 있습니다. 이는 온도에만 의존하는 식이기에 열/일을 가하면 분자의 활발한 정도에 변화가 생기며, 이는 내부에너지를 변화하게 합니다.
요약
1. Joule's 실험을 통해서 열과 일의 등가성을 알 수 있으며, 이 실험을 기반으로 내부에너지가 정의됨
2. 내부에너지는 분자가 갖는 여러 에너지로 구성이 되어있으며, 대표적으로는 병진/회전/진동 운동 에너지가 있다. 에너지가 저장된 방법(정도)은 등분배정리를 통해 알 수 있음
3. (이상기체의) 내부에너지는 온도에만 의존하며 변화량만 측정할 수 있음
[1] 회전운동에 대해 처음 접해보시는 분들은 '일반물리학'을 참고하시면 도움이 될 것입니다.
[2] 이는 내부에너지가 상태함수이기 때문에 가능한 것이며, 상태함수에 대해서는 추후에 구체적으로 살펴볼 것입니다.
[3] 실제 기체의 경우 내부에너지가 온도에만 의존하지 않으며, 마찬가지로 추후에 구체적으로 살펴볼 것입니다.
'전공 개념.zip > 화공열역학' 카테고리의 다른 글
| 2-6 열역학에서의 기본 공정 (Basic Process for Thermodynamics) (0) | 2021.01.20 |
|---|---|
| 2-5 평형과 상률 (Equilibria and Phase Rule) (0) | 2021.01.20 |
| 2-4 열역학에서의 상태와 물성 (Thermodynamic State and State Function) (0) | 2021.01.20 |
| 2-3 닫힌계에서의 물질 수지와 에너지 수지 (Mass and Energy Balance for Closed System) (0) | 2021.01.20 |
| 2-2 열역학 제 1법칙 (the First Law of Thermodynamics) (0) | 2021.01.20 |