
Ⅰ. Title
비누 만들기
Ⅱ. Purpose
1. 계면활성제의 일종인 비누의 성질 및 특성에 대해 알아본다.
2. 비누화 반응과 염석 효과를 이용해서 유지(지방 혹은 기름을 총칭)에서 비누를 만들어본다.
Ⅲ. Theory
1. 결합의 극성여부 및 분자의 극성
1) 극성결합과 비극성 결합
각 원소들은 고유한 양성자 값을 가진다. 이는 중성상태에서 전자의 수를 의미한다. 이런 원소들이 결합할 때, 양성자 수의 개수가 차이가 나면 원자의 전자구름이 치우치는 현상이 발생한다. 즉, 서로 다른 종류의 원자가 결합할 때 하는 결합을 극성결합이라고 한다. 결합을 구성하는 전기음성도의 차이가 클수록 전자의 치우침 현상은 더 크게 나타난다. 하지만, 같은 종류의 원자가 결합할 때는 전기음성도의 차이가 나타나지 않으며 전기구름의 치우침 현상도 발생하지 않는다. 이러한 결합을 보고 비극성 결합이라고 한다.
2) 극성 분자와 비극성 분자
극성결합이 있다면 무조건 그 분자는 극성이라고 오해하지만, 실상은 그렇지 않다. 분자의 구조에 따라서 어떤 구조를 가지고 있는지에 따라 분자의 극성이 결정된다. 중심원자에 대해 대칭적인 구조를 갖지 못한 분자들은 결합의 종류와 관계없이 극성을 띤다. 이런 분자들을 극성분자라고 한다. 또한, 어떤 분자들은 극성 결합으로 구성되어 있지만 분자의 구조적 대칭성 때문에 전자들의 치우침도 대칭을 이룬다. 결국 분자 전체로 봤을 때 극성을 띠지 않으며 비극성 분자라고 한다. 액체상태의 물질들을 섞을 때는 같은 극성을 같는 물질들끼리 잘 섞인다. 비극성인 유지 물질이 극성을 띠는 물과 잘 섞이지 않는 이유가 이때문이다. 하지만, 실험상의 이유 혹은 실생활에서 필요에 의해 이 둘을 섞어야 하는 순간이 존재한다. 이를 위해서 개발된 것이 계면활성제이다.
2. 계면활성제
1) 친수성과 소수성
계면활성제를 이해하기 위해서 친수성과 소수성에 대해서 간단하게 알아보자. 수소와 탄소로 이루어진 알킬기와 같이 탄화수소는 탄소원자들이 사슬모양을 구성한다. 이러한 물질들은 비극성을 띠므로 극성인 물과 쉽게 섞이지 않는다. 이런 물질들을 총칭해서 소수성(hydrophobic) 분자라고 한다. 이에 반해 카복실기, 아미노기 등 극성을 띠는 물질들은 극성인 물과 잘 섞인다. 이러한 분자들을 친수성(hydrophilic) 분자라고 한다.
2) 개념
계면활성제는 한 분자 내에서 친수성 머리부분과 소수성 꼬리부분을 모두 갖는 물질을 말한다. 이런 계면활성제는 수면에 도포되었을 때 특성에 따라 단일막을 형성하기도 하고 이중막을 형성하기도 한다. 3주차 실험에서 사용되었던 스테아르 산(stearic acid)과 같이 소수성을 띠는 알킬기가 매우 길며 친수성 부분이 큰 극성을 띠지 않는 계면활성제가 수면 위에 도포되면 단분자 층을 형성한다. 하지만, 지질과 같이 하나의 친수성 부분에 2~3개의 소수성 원자단이 결합되어 있는 계면활성제가 수면 위에 도포된다면 이들은 이중막을 형성한다. 세포막에 있는 인지질이 형성하고 있는 이중막을 형성하는 대표적인 물질이다.
3) 종류
계면활성제의 구분에 결정적인 역할을 하는 부위는 친수성 부위다. 친수성 부분에 음이온 원자단이 오는 계면활성제를 음이온 계면활성제라고 한다. 그리고 친수성 부위에 양이온 물질이 붙어있다면 이는 양이온 계면활성제를 뜻한다. 한편, 친수성 부위에 어떠한 극성을 띠지 않는 중선 원자단이 오는 계면활성제도 존재한다.
4) 마이셀(micelle)구조와 에멀젼(emulsion)화
계면활성제에 여러 종류가 있지만 극성물질과 비극성 물질이 섞이도록 도와준다는 점에는 변함이 없다. 이는 계면활성제에 의해서 기름이 에멀젼화 되었기 때문에 발생한다. 에멀젼화를 이해하기 위해서 우선 마이셀 구조에 대해 알아야한다. 앞서 설명했듯이 계면활성제는 친수성기와 소수성기를 갖는다. 이때 계면활정제의 농도가 충분하다면 수중에서 자발적으로 화합할 수 있다. 이때 형성된 모양은 구형과 유사하며 이를 마이셀(micelle)이라고 한다. 특히 수중에서 형성한 마이셀을 정상 마이셀이라고 한다. 수중에 계면활성제가 들어갔으므로 친수성 부위가 마이셀의 표면을 구성하며 소수성 부위가 내부를 구성한다. 만약 임계 마이셀 농도 이상의 계면활성제를 기름과 같은 비극성 물질에 넣는다면, 정상 마이셀과 구조가 반대인 역 마이셀을 형성한다. 역 마이셀의 표면은 소수성기가 구성하며 구의 내부에는 친수성 부위가 있다. 계면활성제에 의해 형성된 정상 마이셀과 역 마이셀은 각각의 구조적 특성에 의해 내부에 각각 비극성 물질과 극성 물질이 들어올 수 있다. 마이셀 내부에 들어갈 수 있는 물질의 양은 단일한 계면활성제를 사용할 때보다 마이셀 내부로 침투할 수 있는 보조 계면활성제를 같이 사용할 때 더 증가한다.
기름과 물이 섞이지 않더라도 마이셀 구조의 형성을 이용한다면 둘을 섞이게 할 수 있다. 마이셀 구조가 형성되면 수중 혹은 유기 용매에 분산된다. 용매에 마이셀이 분산되어 형성된 요액을 에멀젼이라고 한다. 계면활성제의 구조적 특성 때문에 마이셀이 2가지 종류가 있듯이 에멀젼에도 2가지 종류가 존재한다. 수중에서 형성된 에멀젼의 마이셀 구조 내부에는 비극성물질이 녹아 있다. 즉 물에 기름이 녹음을 의미하고 이를 oil-in-water(o/w) 에멀젼이라고 한다. 반대로 유기용매에서 형성된 에멀젼의 역 마이셀 구조 내부에는 물이 녹아 있다. 이는 기름에 물이 녹았음을 뜻하고 water-in-oil(w/o) 에멀젼이라고 한다. 계면활성제를 이용하지 않고도 에멀젼을 만들 수 있지만,
마이셀의 형성과 에밀젼은 극성이 다른 물질들을 보다 용이하기 섞을 수 있는 계면활성제의 중요한 특성 중 하나다. 이런 에밀젼을 이용해서 의약품과 버터, 마요네즈 등 다양한 분야에서 활용되고 있다.
3. 비누
1) 비누의 개념 및 세척원리
비누는 비누화 반응을 거쳐 형성된 생성물 중 지방산의 알칼리 염에 해당한다.
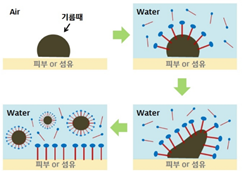
비누는 계면활성제가 갖는 특성을 이용해서 세척을 한다. 보통 비누는 물에서 사용하기 때문에 o/w 에밀젼을 형성하며 옷에 묻은 기름이나 때를 제거한다. 우선 공기 중에 있는 기름 때를 물과 비누에 동시에 접촉시킨다. 그러면 극성의 차이 때문에 소수성 부위가 기름때에 붙는다. 이때 충분한 비누가 물에 있었다고 가정하면 정 마이셀을 형성할 때까지 기름때에 비누가 달라붙는다. 충분한 양 때문에 마이셀이 형성되면 이들은 물속에 분산되고 o/w 에밀젼을 형성한다. 에밀젼이 형성되었기에 물을 제거하면 마이셀도 같이 제거되므로 옷이나 피부에 묻어 있던 기름때도 같이 제거할 수 있다.
2) 비누의 제조방법
비누는 오래 전부터 제작되어 왔다. 과거에는 지방 혹은 기름과 잿물을 이용했다. 잿물 또한 염기성이기 때문에 비누화 반응과 유사한 반응을 일으켜 비누를 얻을 수 있었기 때문이다.
하지만 현대에 이르러서는 비누화 반응을 이용해서 비누를 형성한다. 비누화 반응은 글리세롤과 지방산의 결합으로 형성된 유기물질과 센 염기를 반응시키는 것을 의미한다. 강염기의 대표물질인 수산화나트륨을 예를 들면 수산화나트륨이 유기 물질의 카복실기(-COOH)를 떨어져 나오게 한다. 이때, 지방산 나트륨과 같은 지방산 염과 글리세롤이 형성된다. 이때 형성된 지방산 염 중에서 카복실기가 친수성 부위로 작용하며 알킬기가 소수성을 나타내므로 계면활성제이다. 이 계면활성제를 보고 비누라고 한다.
하지만 비누화 반응만으로는 일상생활에서 사용할 수 없다. 수산화나트륨이 남아있을 수도 있는 문제가 있지만, 용액상태로 비누가 풀어져 있기 때문이다. 이러한 상태의 비누를 다시 뭉쳐야 하는데 이때 염석 효과(salting-out effect)를 이용한다. 이때도 극성의 차이를 활용한다.

수산화나트륨 용액에 의해서 형성된 비누는 에밀젼 상태일 것이다. 수산화나트륨 용액에는 수산화 나트륨도 있지만 물도 있기 때문이다. 이 용액에 염화나트륨과 같은 전해질 물질을 넣었다고 하자. 염화나트륨은 전해질이므로 물속에서 모두 해리한다. 즉, 들어온 전해질 물질이 수화 되는 것이다. 그러면 물에 의해서 마이셀을 형성했던 비누는 주변의 물이 전해질과 상호작용하기 때문에 물과 상호작용을 멈춘다. 즉, 마이셀이 풀어지며 비누만 얻을 수 있게 된다. 이는 간수를 이용해서 두부를 응어리지게 하는 것과 유사한 원리이다. 비누화 반응과 염석 효과를 이용한다면 포화 혹은 불포화 지방과 강한 염기성 용액 그리고 전해질 물질을 이용해서 비누를 직접 만들 수 있다.
하지만, 지나친 수산화나트륨 용액의 사용은 최종적으로 비누를 사용하지 못하게 한다. pH가 지나치게 높으면 사용하기에 위험할 수 있기 때문이다. 이를 위해서 비누화 값(saponification value)를 미리 찾아 두면 도움이 된다. 비누화 값은 지방 1g을 비누화 시킬 때 사용되는 수산화나트륨의 양을 의미한다. 이는 사용하는 버터와 올리브유를 구성하는 지방의 종류 및 분자량을 알 수 있다면 반응계수비를 이용해서 필요한 수산화나트륨의 양을 알 수 있다. 다만, 포화지방과 불포화지방은 서로 종류를 구분해서 반응식을 2개 이상으로 설계해야 하는 번거로움이 있다. 또한 수산화나트륨의 20℃에서 용해도가 1110g/L이므로 수산화나트륨의 분자량을 알고 있다면 필요한 수산화나트륨의 양과 필요한 포화용액의 NaOH의 부피를 알 수 있을 것이다. 100%맞는 수치는 아니겠지만 직접 구한 비누화 값을 이용해서 수산화나트륨을 사용한다면 최소한의 양을 이용할 수 있으며 실제 만든 비누의 pH가 지나치게 높은 현상을 방지할 수 있다.
3) 비누의 한계와 합성세제
물 속에 미네랄 물질(Ca2+, Mg2+ 등 2가 전하를 갖는 이온)이 녹아 있다면 이를 센물(hard water)이라고 한다. 이러한 미네랄 물질과 비누 분자가 반응해서 생긴 염은 물에 잘 녹지 않는다. 즉, 비누의 세척효율이 현저히 떨어진다. 또한 가열한 센물 속에 탄산수소 음이온이 녹아 있었다면, 그 결과로 탄산 음이온이 만들어지며 센물 속의 미네랄 물질과 반응해서 침전물을 만들기도 한다. 특별한 경우일 때, 비누의 사용은 세척을 하지 못할 뿐만 아니라 얼룩을 남길 수도 있는 한계점이 존재한다. 센 물에서 비누를 사용하지 못하는 한계는 합성 세제의 개발로 극복할 수 있었다. 합성세제의 주요 계면활성제는 칼슘이온과 침전반응을 일으키지 않는 친수성 원자군을 갖는다.
Ⅳ. Chemicals & Apparatus
1. Chemicals
유지(버터): 포화지방산의 비율 높음 밀도:0.86~0.87g/cm3
올리브유: 불포화지방산의 비율 높음
포화 NaOH 용액
분자량 39.9997g/mol, 밀도 2.13g/cm3, 용해도 1110g/L (20℃), 녹는점 800.4℃, 끓는점 1400℃
포화 NaCl 용액
분자량 58.443g/mol, 밀도 2.17g/cm3, 용해도 359g/L (20℃), 녹는점 318℃, 끓는점 1388℃
2. Apparatus
비커(100mL, 500mL), 눈금 실린더(10mL), Hot plate, 유리막대, 온도계, 스탠드, 클램프, 파스퇴르 피펫, 필러
Ⅴ. Procedure
1. 버터 10g과 올리브유 1g이 담긴 비커를 유리막대로 저어주면서 물 중탕으로 35℃까지 가열한다.
2. 포화 NaOH 용액 3mL를 천천히 넣은 후 일정한 온도 (약 50℃~60℃)를 유지하도록 계속 가열한다. 이때, 유지가 고체화가 되지 않도록 60℃를 넘지 않도록 한다. 가열하는 동안 비커의 용액을 계속 한 방향으로 저어주어야 한다. 이 과정을 15분에서 20분동안 진행한다.
3. 다시 포화 NaOH 2mL를 넣어주고 용액이 투명하게 될 때까지 약 20분 동안 한 방향으로 저어주면서 가열한다.
4. 다음과 같은 방법으로 비누화 반응이 완결되었는가를 확인한다
1) 손끝으로 문지르면 미끈미끈하면서 엷은 비늘모양이 된다.
2) 유리막대 끝에 묻혀서 들어올리면 끈기가 있다.
3) 투명하고 균일한 풀 모양의 용액이 된다.
4) 손에 묻힐 때 기름기나 물방울이 느껴지지 않는다.
5) 용액전체가 반투명하고 거품이 있는 상태이다.
6) 소량의 알코올을 넣으면 완전히 녹는다.
5. 비누화 반응이 끝난 용액에 포화 NaCl을 3mL를 3번에 나누어 넣고 그때마다 5-6분씩 가열한다. 용액이 불투명하게 될 때까지 진행해야 한다.
6. 생성된 비누를 종이컵에 부어 40℃로 설정한 오븐에서 하루동안 건조한 뒤 다음날 찾아간다.
Ⅵ. Data & Result

Ⅶ. Discussion
포화 NaOH를 넣고 계속 중탕을 진행한 결과 용액이 처음에 비해 색이 하얗게 변했다. 유지물질이 약간 침전된 것 같은 모습을 관찰했지만, 실험에 큰 영향을 미치지 않을 것이라고 예상하고 계속 진행했다. 유리막대 끝에 용액을 묻혔을 때 적당한 끈기가 있었고, 가열을 통해 용액이 처음보다 투명한 풀 모양으로 변한 것을 보아 비누화 반응이 완결되었다고 판단했다. 포화 NaOH를 사용했기 때문에 안전상의 이유로 손과 용액이 직접적으로 닿는 검증방법은 생략했다. 비누를 실용화하려고 염석 효과를 이용하기로 했으며 전해질로 NaCl을 선정했다. 포화 NaCl 용액을 유기 용액에 넣고 섞자 처음에 비해서 알갱이들이 커진 것을 확인할 수 있었다. 또한, 실생활에서 보던 것과 유사하게 비누가 하얗게 변하는 것 또한 확인할 수 있었다. 하루동안 응고시킨 뒤 비누를 찾으러 갔을 때, 다른 조와 우리 조의 비누가 비교적 다른 형태였음을 알 수 있었다. 다른 조원분들의 비누는 대부분 하얗고 양이 충분했음에도 불구하고 우리 조의 비누는 버터색이 조금 남아있었으며 양도 부족했다. 심지어 표면이 매끄럽지도 않았다. 실험 상황에 대해 상기해보자, 한가지 놓친 점이 있었음을 알 수 있었다. 중탕할 때 물의 온도를 일정하게 유지시켰어야 했는데 온도가 조금 낮은 것을 확인한 후 hot plate를 이용했기 때문에 균일한 온도로 중탕하지 못했었다. 균일하지 못했던 중탕 온도와 목표한 온도보다 낮고 높은 온도에서의 중탕이 비누를 더 정확하게 만드는데 방해한 요인이라고 판단된다. 또한, 비누화 값을 정확하게 고려하지 않고 제시된 포화 NaOH용액을 사용했었다. 형성한 비누의 pH를 직접 측정하는 못했다. 하지만, 비누화 값을 고려하지 않고 비누를 만든 것은 비누가 형성되더라도 pH가 과하게 커서 사용하지 못하는 위험성을 갖고 있기에 유의해야 한다.
Ⅷ. Reference
1. 대한화학회, 표준 일반화학실험 제 7판, 천문각, 2011, pp. 54, 276~282, 298~300
2. John R.Rumble, CRC Handbook of Chemistry and Physics 85th edition, pp. 4-84~4-85, 15-2
3. Brown 외 6인, Chemistry The Central Science 14th edition, Pearson, 2019, pp. 167~169, 1119~1111
'자료.zip > 일반화학실험' 카테고리의 다른 글
| 크로마토그래피(Chromatography) (2) | 2021.02.09 |
|---|---|
| 나일론 합성 (5) | 2021.01.30 |
| 엔탈피 측정 (0) | 2021.01.28 |
| 몰질량 측정 (0) | 2021.01.19 |
| 아보가드로 수의 결정 (0) | 2021.01.18 |