
Ⅰ. Title
재결정
Ⅱ. Purpose
산-염기 성질을 이용해서 용해도가 비슷한 두 물질 acetanilide와 Benzonic acid를 재결정을 통해 분리한다.
Ⅲ. Theory
1. 용해 과정
용액이 형성되려면 기존의 물질(용매)에 첨가한 물질(용질)이 균일하게 퍼져야 한다. 이러한 용액을 형성하는 물질의 능력은 1) 물질이 서로 섞이려고 하며 저항이 없는 상황에서 부피가 작은 물질이 부피가 큰 물질에 대해 확산되는 정도 2) 용해 과정에서 영향을 미치는 분자 사이의 상호작용의 정도에 의하여 결정된다.
1) 혼합에 대한 자연적인 경향성 (엔트로피)
혼합을 쉽게 이해하고자 우선 기체의 혼합 과정에 대해 고려해보자. 용기에 담긴 두 종류의 기체가 장벽으로 분리되어 있다고 하자. 만약 장벽을 제거하면 두 기체는 자발적으로 혼합되어 용액을 형성한다. 기체 분자들은 분리된 상태에 놓일 때보다 서로 섞여 무질서하게 분포할 때 더 큰 엔트로피 값을 갖기 때문이다. 기체의 혼합이 발생할 때는 계의 엔탈피는 거의 일정하다. 이는 기체 분자 사이에는 상호작용이 거의 없기 때문이다. 하지만 기체와 달리 용매 혹은 용질이 고체나 액체일 때는 분자 사이의 상호작용이 용액의 형성에 중요한 비중을 차지한다. 분자사이의 힘과 이와 관련된 에너지는 계의 엔탈피를 구성한다. 그리고 계의 엔탈피 감소는 분자 사이의 상호작용 증가를 의미한다. 이렇듯 어떤 반응이 자발적인지, 비자발적인지를 결정하는 데에는 엔탈피의 변화량과 엔트로피의 변화량을 동시에 고려해야 한다.
2) 분자간 힘이 용액의 형성에 미치는 영향
용액을 구성하는 용매와 용질 입자 사이에 작용할 수 있는 분자간 힘의 종류에는 분산력, 쌍극자-쌍극자 인력, 수소 결합, 이온-쌍극자 결합 등이 존재한다. 이 힘들은 용매와 용질을 구성하는 물질이 어떤 물질인가에 따라 결정된다. 용액이 형성되는 과정에서 3가지 분자간 상호작용을 고려해야 한다. ① 혼합을 위해선 용질 입자 사이의 거리가 충분히 멀어져야 하며, 이는 용질 입자들 사이의 상호작용을 극복해야 함을 의미한다. ② 마찬가지로 용질이 분산되려면 용매 입자 사이의 거리가 충분히 떨어져야 하며, 이는 용매 입자들 사이의 상호작용을 극복할 힘이 필요한 것을 뜻한다. ③ 용질과 용매 각각의 입자 사이의 거리가 멀어진 상태에서 용질과 용매 입자들 사이에서 상호작용이 발생해야 두 물질이 섞일 수 있다. 용액의 형성은 이 3가지 분자간 상호작용의 상대적인 크기에 의하여 결정된다. 용액은 용매 상의 상호작용과 용질 사이의 상호작용의 전체적인 세기보다 용질과 용매에 작용하는 상호작용의 힘의 크기가 더 클 때 형성된다.
3) 용액 형성의 에너지론
이제 용액 형성에 미치는 두 인자를 고려하여 용액 형성을 에너지 관점에서 살펴보도록 하자. 대부분의 경우 용해 반응이 발생할 때, 엔탈피의 변화도 같이 발생한다. 엔탈피의 변화를 살펴보기 위하여 헤스 법칙을 이용해보자. ① 뭉친 용질 입자들이 각각의 입자로 분리되는 과정에서 수반되는 엔탈피 변화를 ∆H용질 이라고 하자. 용질 입자 사이의 인력을 끊어야 하므로 열에너지를 흡수하는 흡열 과정이며, 이는 ∆H용질>0 을 의미한다. ② 뭉쳐 있는 용매 입자들도 각각 입자로 분리되는 과정 중 발생하는 엔탈피 변화를 ∆H용매 라고 하자. 용질 입자의 엔탈피 변화와 마찬가지로, 용매 입자들도 입자간 인력을 극복해야 하므로 에너지를 흡수해야 한다. 이는 ∆H용매>0 를 뜻한다. ③ 용질과 용매 입자가 혼합될 때 발생하는 엔탈피 변화를 ∆H혼합 이라고 하자. 용질과 용매가 혼합되는 것은 물질 사이의 인력으로 인해서 보다 안정해지는 것을 의미하므로 에너지가 방출되는 발열 과정이다. 이는 ∆H혼합<0 을 의미한다. 용액 형성에서 발생하는 엔탈피 변화를 ∆H용액 이라고 하자. 이는 ①~③에서 정의한 엔탈피 변화의 총합을 의미하며 수식으로 표현하면 다음과 같다.
∆H용액=∆H용질+∆H용매+∆H혼합
∆H용액 의 부호를 파악하면 해당 용액이 형성될 수 있는지 파악할 수 있다. 만약 ∆H용액<0 이라면, 해당 용액은 쉽게 발생하는 경향이 있다. ∆H용액>0 이더라도 용액이 형성될 수는 있지만 만약 이 크기가 너무 크다면 용액이 형성되기는 쉽지 않다. 이를 밑의 그림으로 살펴보자.
형성된 용액이 이온성 수용액이라면 용액 형성의 엔탈피 변화를 조금 다른 관점에서 살펴볼 수 있다. 이온성 수용액의 경우 용매가 물이고 용질이 이온결합 물질이다. 우선 용질에 대해 먼저 살펴보자. 용질이 분리될 때 발생하는 에너지는 격자 에너지와 같다. 즉, ∆H용질→∆H격자 로 표현할 수 있다. 이온 사이에 작용하는 정전기적 인력을 극복해야 하기 때문에 ∆H격자>0 이다. 그리고 용매의 분산과 수화 과정이 거의 동시에 발생하기 때문에 ∆H용매+∆H혼합 을 동시에 생각하며 이를 ∆H용매+∆H혼합→∆H수화 로 표현할 수 있다. 물속에 분산된 이온은 용매에 둘러싸이며 안정해지기 때문에 수화과정은 발열 과정이고 ∆H수화<0 이다. 이를 종합하여 용액이 만들어 질 때 발생하는 엔탈피를 다음과 같은 수식으로 바꾸어 표기할 수 있다.
∆H용액=∆H격자+∆H수화
이온결합 물질이 물에 용해되어 형성된 용액은 그 과정에서 에너지를 방출하기 때문에 상온에서 쉽게 용액이 형성된다.
한편, 발열 용해 과정과 흡열 용해 과정과 달리 엔탈피의 변화가 거의 발생하지 않으면서도 용액의 형성될 수 있는데, 이는 엔트로피의 증가로 설명할 수 있다. 헵테인과 펜테인을 예로 들어보자. 이 두 물질은 모두 무극성이여서 ∆H용질+∆H용매 의 크기가 ∆H혼합 의 크기와 비슷하다. 그래서 ∆H용액≈0 이다. 하지만, 물질은 서로 혼합될 때 더 큰 엔트로피 값을 가지며, 자연계에서 반응은 엔트로피가 증가하는 방향으로 발생하기 때문에 자발적으로 용해가 발생한다.
2. 용해도와 용해 정도에 따른 용액의 종류
1) 용해와 결정화
용해 과정은 용매 물질에 용질 물질이 혼합되어 퍼지는 과정을 의미한다. 하지만 용매에 용질이 혼합될수록 용질입자끼리 서로 부딪혀서 다시 원래 용질 상태로 돌아가는 반응도 증가한다. 이렇듯 용액 형성의 역반응, 즉 용매에 혼합된 용질 입자가 다시 용질의 덩어리로 석출되는 과정을 결정화(crystallization)라고 한다. 이 과정을 반응식으로 표현하면 다음과 같다. (표기상의 어려움으로 정반응과 역반응을 따로 표기하였다.)

용해 반응이 발생하는 속도와 결정화 반응이 진행되는 속도가 같을 때 해당 용액은 동정평형(dynamic equilibrium)을 이루었다고 한다. 또한 일정한 온도에서 특정한 양의 용매에 대하여 동적평형에 이르기까지 필요한 용질의 양을 용해도(solubility)라고 한다.
2) 용해도에 따른 용액의 종류
포화용액(saturated solution)은 용매에 대하여 동적평형을 이루고 있는 용액을 의미한다. 만약 포화용액에 용질이 더 가해진다면 그 용질은 더 이상 녹을 수 없다. 반면, 포화용액을 형성하는데 필요한 용질의 양보다 더 적은 양의 용질을 녹여서 만든 용액을 불포화용액(unsaturated solution)이라고 한다. 한편, 높은 온도에서 형성한 포화 용액을 식혀서 용액을 제조하는 경우 등 특별한 조건에서 해당 온도의 용해도에 따른 용질의 양보다 더 많은 용질이 녹은 용액이 있는데 이를 과포화용액(supersaturated solution)이라고 한다. 과포화용액은 매우 불안정한 상태에 놓여있다. 그래서 결정씨(seed crystal)를 이용하거나 용기에 충격을 주어 과포화용액에 자극을 준다면, 여분의 용질이 결정화되어 과포화용액이 포화용액으로 바뀐다.
3. 용해도에 영향을 주는 요인
용해도는 일정한 값이 아니라 특정한 변수들의 조작으로 인하여 충분히 변할 수 있는 수치다. 용해도는 크게 분자구조에 의한 용질과 용매의 상호작용의 차이, 온도, 그리고 기체의 경우 압력에 의해서도 용해도 값이 변한다.
1) 용질과 용매의 상호작용으로 발생하는 용해도 차이
앞서 살펴봤듯이 용해과정을 이해하려면 용매 사이의 인력, 용질 사이의 인력, 그리고 용질과 용매 사이의 인력 사이의 관계를 고려해야 한다. 하지만 특별한 경우를 제외고는 용액 형성에는 용질과 용매 사이의 상호작용이 큰 영향력을 미친다.
용매와 용질의 상호작용을 극성 사이의 관계에 대해 살펴보기 위하여 특정 온도에서 물과 헥세인에 대한 알코올의 용해도를 살펴보도록 하자. 이때 ∞ 는 용질이 용매에 완전히 섞일 수 있음을 의미한다.
|
알코올 |
물에 대한 용해도 mol/100g |
헥세인에 대한 용해도 mol/100g |
|
CH3OH (methanol) |
∞ |
0.12 |
|
CH3CH2OH (ethanol) |
∞ |
∞ |
|
CH3(CH2)2OH (propanol) |
∞ |
∞ |
|
CH3(CH2)3OH (butanol) |
0.11 |
∞ |
|
CH3(CH2)4OH (pentanol) |
0.030 |
∞ |
|
CH3(CH2)5OH (hexanol) |
0.0058 |
∞ |
알코올은 극성을 나타내는 원자단인 -OH를 가지고 있어서 극성을 띠는 물에는 항상 잘 녹을 것처럼 보인다. 하지만, 기대와는 달리 탄화수소 사슬의 길이가 특정 값 이상을 나타내면 극성 용매에 대한 용해도보다 무극성 용매에 대한 용해도가 더 큰 값을 보인다. 이는 분자 내에서 극성 부분과 무극성 부분이 갖는 전자구름의 영역의 상대적 크기의 차이에 의하여 발생한다.

위의 그림은 알킬기의 길이가 충분히 차이나는 두 알코올의 전자구름 분포를 도식화한 것이다. 탄화수소 사슬의 길이가 짧다면 -OH가 차지하는 전자구름 영역이 커서 극성 용매와 쉽게 상호작용할 수 있다. 하지만, 탄소수가 증가하면 극성을 띠지 않는 영역의 전자구름의 크기가 더 크기 때문에 알코올이 물을 쉽게 끌어당기지 못하여 용해도가 감소하며, 오히려 무극성 용매인 헥세인에 대한 용해도가 증가하는 것을 알 수 있다. 이 점을 통하여 3가지 사실을 알 수 있다. 첫 번째로 분자 사이의 인력은 전자구름의 분포에 영향을 받는데, 용질과 용매가 갖는 분자간 인력의 종류가 유사할 때 쉽게 용해가 된다. 이 현상을 ‘비슷한 것은 비슷한 것을 녹인다’(like dissolves like)라고 표현할 수 있다. 그리고 용해도를 살펴보려면 용질의 분자구조와 전자구름의 분포 또한 살펴보아야 한다. 마지막으로 특정 용질이 극성 용매에만 또는 무극성 용매에만 녹을 수 있는 것이 아니라 전자구름에 의한 상호작용에 의하여 극성과 무극성 용매 모두에도 녹을 수 있음을 알 수 있다.
한편, 기체 용질의 경우 기체 분자의 분자량도 물에 대한 용해도에 영향을 미친다. 일반적으로 기체 물질의 분자량이 크면 분산력도 크기 때문에 용매와 용질이 서로 더 쉽게 끌어당길 수 있다. 이는 용액이 더 쉽게 형성될 수 있음을 뜻한다. 즉, 기체의 크기 혹은 분자량과 물에 대한 기체의 용해도는 비례한다.
2) 압력에 의한 효과
용질이 고체나 액체인 경우, 외부의 압력이 변하더라도 용해도가 크게 변하지 않는다. 왜냐하면 어떤 물질이 고체 혹은 액체 상태라면 각 상태에서 물질은 고유한 부피를 차지하고 있으며, 이 부피는 압력에 의하여 쉽게 변하지 않기 때문이다. 그러나 기체 상태의 물질의 경우, 외부 압력의 변화에 민감한 영향을 받으며 이는 기체 물질의 용질이 압력에 의해 용해도가 변하는 이유를 설명한다. 기체의 용해속도와 탈출속도가 같을 때 용액은 평형을 이룬다. 일반적으로 용매 위의 있는 기체 용질의 비율의 증가, 즉 기체의 부분압력이 커질수록 용매에 대한 기체의 용해도도 증가한다. 만약 용매와 기체가 들어있는 실린더에 압력이 작용한다면 실린더의 부피는 감소하며 내부의 압력은 증가한다. 그 결과 기존 평형 상태보다 기체 분자들이 수면에 더 부딪힐 수 있게 되어 용매에 녹는 기체의 양은 다시 평형을 이룰 때까지 증가한다. 이와 같이 일정한 온도에서 액체 용매에 대한 기체의 용해도는 용매 위의 기체의 부분압력에 비례하는 것을 알 수 있으며, 이를 헨리의 법칙 (Henry’s law)라고 한다. Sg 를 용매에 대한 기체의 용해도, Pg 를 용매 위에 존재하는 기체의 부분압력, 그리고 k 를 Henry 법칙 상수라고 할 때, 다음과 같은 식을 얻을 수 있다.
Sg=kPg
3) 온도 변화에 의한 효과
고체 용질과 기체 용질에 대하여 용해도는 비교적 다른 양상을 보인다. 우선 고체 용질의 용해과정은 대부분 흡열 과정이기 때문에 용액에 가해진 열이 증가하여 용액의 온도가 상승한다면 용해도도 증가한다. 예외적으로 Ce2(SO4)3는 용해과정 중 열을 방출하기 때문에 용액의 온도가 증가하면 용해도가 감소하는 것을 보인다. 기체 용질의 경우 용액이 열을 받으면 기체의 평균 분자 운동 에너지가 증가한다. 이는 기체가 기존보다 더 쉽게 용매에서 탈출할 수 있음을 뜻한다. 따라서 기체가 용질인 경우 용액의 온도에 대하여 기체의 용해도는 반비례관계를 나타낸다.
4. 순물질과 혼합물의 가열곡선
가열곡선은 가해준 열과 계의 온도 사이의 관계를 나타낸다. 가열곡선을 이용하면 물질의 상태, 물질의 온도가 상승할 때 필요한 열의 양, 상태가 변화할 때 필요한 열량 등을 알 수 있다. 일반적으로 물질이 열을 받으면 온도가 올라가므로 가열곡선은 대개 우상향하는 개형을 나타내지만, 가열하는 물질이 순물질일 때와 혼합물일 때 그 양상이 조금 다르게 나타난다.
1) 순물질의 가열곡선

이해를 돕기 위하여 순수한 물을 가열했을 때 나타나는 곡선에 대해 살펴보자. 가열 곡선은 크게 기울기가 0인 부분과 기울기가 양수인 부분으로 나누어서 볼 수 있다. 우선, 받은 열의 양과 관계없이 온도가 일정한 부분을 알아보자. 이 부분은 물질의 상태가 변하는 구간으로 물질이 열을 받더라도 그 열을 물질의 온도를 높이는데 사용하지 않고 물질의 상태를 바꾸는데 소비한다. 이 구간에서는 서로 다른 상태를 띠는 물질이 공존하며, 물의 경우 첫번째 상 변화 구간에서는 얼음과 물이, 두 번째 수평 구간에서는 물과 수증기가 같이 존재한다. 반면 가열된 만큼 온도가 올라가는 것을 보여주는 기울기가 양수인 부분에서는 물질이 항상 한 가지 상태로만 존재한다.
2) 혼합물의 가열곡선

혼합물의 가열 곡선은 순물질의 가열곡선과 조금 다른 양상을 보인다. 물과 에탄올을 혼합한 용액을 대상으로 살펴보자. 물과 에탄올을 혼합한 경우, 순물질의 가열곡선과 달리 기울기가 매우 작은 구간이 존재한다. 이 구간은 혼합물에서 끓는점이 낮은 물질의 상변화가 발생하는 구간이다.
에탄올은 물보다 끓는점이 낮기 때문에 물보다 먼저 끓을 수 있다. 에탄올은 끓는점에 도달하면 그 이후부터 받은 열을 상태가 변화하도록 사용하여 온도 변화에 영향을 미치지 않는다. 하지만 물은 에탄올의에 끓는점에서 기화하지 않으므로 가열된 만큼 받은 열을 물의 온도를 증가하는데 사용한다. 따라서 순물질과 달리 혼합물이 가열되어 더 낮은 온도에서 끓는 물질의 끓는점에 도달해 상태가 변화하더라도 온도가 일정하지 않으며, 온도가 계속 증가하는 구간을 확인할 수 있다.
3) 순물질과 혼합물의 가열곡선 경향성의 차이와 물질의 순도 파악
4-1), 4-2)를 통해서 혼합물의 경우 물질의 상태가 변하더라도 온도가 일정하지 않고 온도가 특정 범위에서 변화하는 것을 알 수 있다. 이 성질을 통해서 물질의 순도에 대해 파악할 수 있다. 얻으려고 하는 물질에 불순물이 포함되어 있다면, 가열되어 상태가 변할 때 온도가 상승한다. 만약 불순물이 많이 포함되어 있다면 상변화시 측정되는 온도 구간이 넓어지며, 순수한 물질일수록 이 구간의 넓이는 줄어든다. 하지만, 보다 확실한 논의를 하려면 일반적인 온도계의 사용이 아닌 가열 시간에 대해 온도 변화를 정확하게 측정할 수 있는 기구를 이용해야 한다. 일반적인 온도계를 사용하면 정확하게 온도 변화의 경향성이 달라지는 지점을 정확하게 측정할 수 없기 때문이다.
5. 재결정의 이해
이번에 진행하는 실험에서 아세트아닐라이드와 벤조산의 혼합 시료를 온도와 pH에 따른 용해도의 차이를 이용하여 순수한 아세트아닐라이드와 벤조산을 분리한다. 이번 실험을 도식화해서 표현하면 다음과 같다.
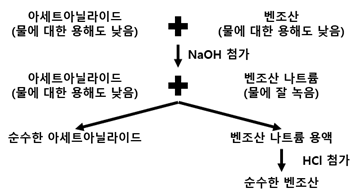
물에 대한 아세트아닐라이드와 벤조산의 용해도, 각 물질의 분자량 등 정보를 이용해서 분리 과정 중 고려해야 하는 반응들과 필요한 시료의 양들에 대해서 알아보자.
1) pH에 의한 용해도 변화를 이용한 벤조산 용해 및 필요한 3M NaOH 수용액의 부피
상온(25℃)에서 벤조산의 용해도는 3.4g/L, 아세트아닐라이드의 용해도는 5.4g/L으로 물에 잘 녹지 않는 것을 알 수 있다. 물에 대한 용해도나 온도에 의한 용해도 차이가 크기 않아서 단순한 온도에 의한 용해도 차이를 이용하면 시료를 분리할 수 없다. 그래서 벤조산이 pH에 의하여 용해도가 달라지는 것을 이용하여 벤조산과 아세트아닐라이드의 용해도를 차이를 두고 시작한다. 물에 의한 용해도가 낮기 때문에 시료와 물을 혼합하더라도 큰 변화를 관찰하기 힘들다 하지만, NaOH 수용액을 첨가하면 상황이 달라진다. 벤조산의 분자식은 C7H6O2이지만, 시성식으로 표현하면 벤조산은 C6H5COOH로 카복시기를 포함하고 있는 카르복실산이기 때문에 산성을 띠는 물질임을 알 수 있다. 그래서 염기성을 띠는 수산화나트륨과 벤조산이 반응하면 중화반응이 일어난다. 한편, 벤조산은 약산이기 때문에 벤조산에서 유래한 이온은 물과 반응하여 다시 벤조산으로 돌아가고자 한다. 벤조산과 NaOH에 대한 반응식과 생성된 염에 대한 염의 가수분해 반응은 아래와 같다.

만약 벤조산을 중화하기 위해 필요한 NaOH를 딱 맞게 첨가하면 염의 가수분해에 의하여 남아있는 벤조산이 있을 수 있으며, 이는 시료에 완전한 분리에 방해가 된다. 그래서 중화하는데 필요한 양의 1.5배에 해당하는 NaOH 수용액을 넣어서 염의 가수분해 반응을 방지하여 벤조산이 모두 녹을 수 있도록 한다.
이제 3M NaOH 수용액을 얼마나 넣어주어야 하는지 살펴보도록 하자. 벤조산과 아세트아닐라이드 혼합 시료 2α g 중 50%를 벤조산이라고 가정하므로, 시ㅇ료 속 벤조산의 질량을 α g 이라고 할 수 있다. 벤조산의 분자량은 122.122g/mol 이므로 시료 속 들어있는 벤조산의 몰수는 α/122.122mol 이다. 한편, 벤조산이 모두 반응하기 위하여 반응 몰수비에 따라서 α/122.122mol 이 필요하다. NaOH 수용액의 몰 농도가 3M이므로 필요한 부피를 V라고 했을 때 다음 식이 성립한다.

분리를 위해서 사용한 시료의 양이 1g 이므로 α=0.5 를 위의 식에 대입하고 완전한 벤조산의 용해를 위하여 중화에 필요한 용액의 부피의 1.5배를 하도록 한다.

따라서 벤조산의 용해를 위하여 3M NaOH 수용액이 2.0mL정도 필요하다. 만약 시료를 정확하게 1g 으로 사용하지 못했다면, 측정된 수치의 절반을 α 에 대입하면 실험을 진행할 때 필요한 수산화나트륨 용액의 양을 알 수 있다. 하지만 시료 자체가 완벽한 균일 혼합물이 아니기에 시료를 덜어서 사용할 때 해당 시료 중 벤조산이 50% 이상을 차지할 수 있기 때문에 염기성이 아니라면 NaOH 수용액을 조금 더 넣어주면 된다.
2) 온도에 의한 용해도 변화를 이용한 아세트아닐라이드의 석출
NaOH를 충분히 넣었다면 해동 용액에서 고체상태로 남아있는 물질은 아세트아닐라이드 또는 불순물이 남아있다. 아세트아닐라이드의 용해는 흡열반응이기 때문에 높은 온도의 물에서 더 많이 녹을 수 있다. 물이 증발되지 않도록 충분히 높은 온도에서 시료가 들어있는 용액을 가열하면 아세트아닐라이드보다 용해도가 낮은 불순물을 제외하고는 모두 녹을 수 있다. 만약 해당하는 불순물이 존재한다면 거름과정을 통해서 걸러주면 된다. 아세트아닐라이드조차 녹은 용액을 다시 식히면 용해도의 변화에 의하여 녹아 있던 아세트아닐라이드가 다시 결정형태로 석출된다. 이때, 용액을 지나치게 빨리 냉각해서 아세트아닐라이드 사이에 불순물이 섞이거나 결정이 너무 작게 형성되지 않도록 유의한다. 결정을 다시 거르고, 다시 결정화된 아세트아닐라이드가 용해되지 않도록 차가운 물을 이용해서 표면에 붙어있을 벤조산 나트륨을 최대한 제거하면 순수한 아세트아닐라이드를 얻을 수 있다.
3) pH와 온도에 의한 용해도 변화를 이용한 벤조산 재결정 및 필요한 5M HCl 수용액의 부피
아세트아닐라이드를 석출한 용액에는 NaOH에 의하여 용해된 벤조산이 존재하며, 용액을 다시 산성으로 바꾼다면 대부분의 벤조산은 용해되지 못하여 석출된다. 거른 용액에 5M HCl 수용액을 넣었을 때 발생하는 반응들과 벤조산을 모두 석출하기 위하여 필요한 HCl 수용액의 양을 살펴보자.

NaOH에 의해 용해된 벤조산의 몰수에 대해 α/122.122mol=t mol 이라고 하자. 반응 몰수비에 따라서 벤조산 나트륨은 t mol 이 있을 것이며, 용해시키는데 사용하고 남은 NaOH가 0.5t mol 이 있을 것이다. 벤조산 나트륨을 모두 벤조산으로 석출하기 위하여 남아있던 NaOH와 벤조산 나트륨과 모두 반응해야 하므로 HCl 1.5t mol 이 필요하다. 즉, 아세트아닐라이드 석출과정에서 넣어주었던 NaOH의 몰수만큼 HCl을 넣어주면 된다. t에 원래 값을 대입하고, HCl의 몰 농도가 5M이라는 것을 감안했을 때, 다음 식을 세울 수 있다. 필요한 HCl 수용액의 부피를 V라고 하자.

완전한 산성을 위하여 1mL를 첨가하는 것과 시료에서 α=0.5 라고 가정하므로 이를 대입해서 계산하면 필요한 5M HCl 수용액의 부피를 알 수 있다. 이를 V’라고 하자.

따라서 2.2mL 정도의 5M HCl 수용액이 필요하며, 이를 첨가하면 벤조산을 얻을 수 있다. 벤조산이 포함된 용액을 다시 가열하여 물에 대한 벤조산의 용해도를 높여 벤조산을 모두 녹인다. 시료에 첨가된 벤조산의 양에 따라서 물의 양이 충분하지 않을 수 있으므로 벤조산이 모두 녹을 때까지 물을 넣고 끓지 않게 가열한다. 앞서 아세트아닐라이드를 가열했던 것과 같이 최대한 순수한 벤조산을 얻도록 천천히 냉각하며, 재결정된 물질을 거르면 순수한 벤조산을 얻을 수 있다.
Ⅳ. Chemical & Apparatus
1. Apparatus
저울(weighing machine), 오븐(oven), 가열판(hot plate), 비커 100mL 2개, 눈금 실린더(measuring cylinder), 피펫(pipette), 유리 막대(glass rod), 시계 접시(watch glass), 온도계, 뷰흐너 깔때기, 감압 플라스크(filter flask), 감압기(aspirator), 거름 종이(filter paper), pH 지시종이(pH paper), 목장갑(cotton work gloves)
2. Chemical
벤조산과 아세트아닐라이드 혼합물 (1:1), 3M NaOH 수용액, 5M HCl 수용액
|
물질 이름 |
화학식 |
화학식량(g/mol) |
밀도(g/mL) |
녹는점(℃) |
끓는점(℃) |
|
아세트아닐라이드 |
C8H9NO |
135.063 |
1.2190 |
114.3 |
304 |
|
벤조산 |
C7H6O2 |
122.122 |
1.2659 |
122.35 |
249.2 |
|
염산 |
HCl |
36.4610 |
3.6461 |
-114.17 |
-85 |
|
수산화나트륨 |
NaOH |
39.997 |
2.13 |
323 |
1388 |
Ⅴ. Procedure
실험 1. Acetanilide의 분리와 재결정
1) 미리 준비된 벤조산, 아세트아닐라이드의 혼합시료(1:1)를 약 1g의 무게를 측정하여 100mL 비커에 넣고 15mL의 물을 가한다.
2) 시료의 50%가 벤조산(0.5g)이라고 생각하고 이를 중화시키는데 필요한 3M NaOH 수용액의 부피를 계산하여 그 양의 1.5배를 100mL 비커에 가한다. (약 2.0mL 정도)
3) 충분히 저어준 후에 pH 지시종이로 용액의 pH가 염기성인지를 확인한다.
(만약 염기성이 아니면 NaOH 수용액을 몇 방울 더 넣어주고 다시 확인한다.)
4) 용액을 끓을 때까지 가열한다. (고체가 완전히 녹지 않았다면 NaOH를 더 가해서 완전히 녹여준다.)
5) 비커를 시계접시로 덮고 용액이 식을 때까지 기다린다. (급하게 냉각시킬 경우 결정이 재배열 되는 시간이 모자라 작은 결정 밖에 생성되지 않아 완전한 결정화가 일어나지 않는다.)
6) 용액이 식으면서 서서히 아세트아닐라이드 결정이 석출된다. (잘 식지 않는다면 찬물이나 얼음을 사용한다.)
7) 거름 종이의 무게를 미리 잰 후, 뷰흐너 깔때기를 이용하여 침전물을 여과하고 차가운 물 2mL씩 2~3회 정도 씻어준다. (여과액 전체는 실험 2에서 다시 사용해야 하므로 버리지 않도록 주의한다.)
8) 오븐에서 침전물을 완전히 말려 무게를 재고 녹는점을 측정한다.
실험 2. Benzoic acid의 분리와 재결정
1) 실험 1에서 얻은 여과액에 5M HCl 용액을 가하면 용액이 산성이 되면서 벤조산이 뿌옇게 결정화되는 것을 볼 수 있다. (가하는 HCl 용액의 양은 앞서 첨가한 NaOH 용액의 양과 비슷하게 첨가하고, 확실히 산성을 만들어 pH paper로 확인하다.)
2) 용액이 끓을 때까지 가열한다. (고체가 완전히 녹지 않았다면 물을 2~3mL 더 가해 완전히 녹여준다.)
3) 100mL 비커에 시계 접시를 덮어 완전히 식힌다.
4) 용액이 식으면서 서서히 벤조산 결정이 석출된다.
5) 뷰흐너 깔때기에 거름종이를 깔고, 침전물을 여과한 후 차가운 물 2mL씩 2~3회 정도 씻어준다.
6) 거름종이를 오븐에 완전히 말려 무게를 재고, 녹는점을 측정한다.
<주의사항>
1) 재결정 석출 시 과한 충격을 가하거나 온도를 급격히 내리면 결정이 작아져 걸러지지 않을 수 있으니 주의한다.
2) 남은 산 용액은 폐산 통에, 남은 염기 용액은 폐염기 통에 버린다.
3) 실험이 끝난 후 석출된 시료들은 잘 포장하여 고체 폐기물에 버린다.
4) 감압기(Aspirator)를 사용할 때 역류하지 않도록 주의한다.
5) 산, 염기를 사용하므로 주의한다.
6) 녹는점 측정기 사용시 capillary가 부러지지 않도록 주의한다.
Ⅵ. Data & Result
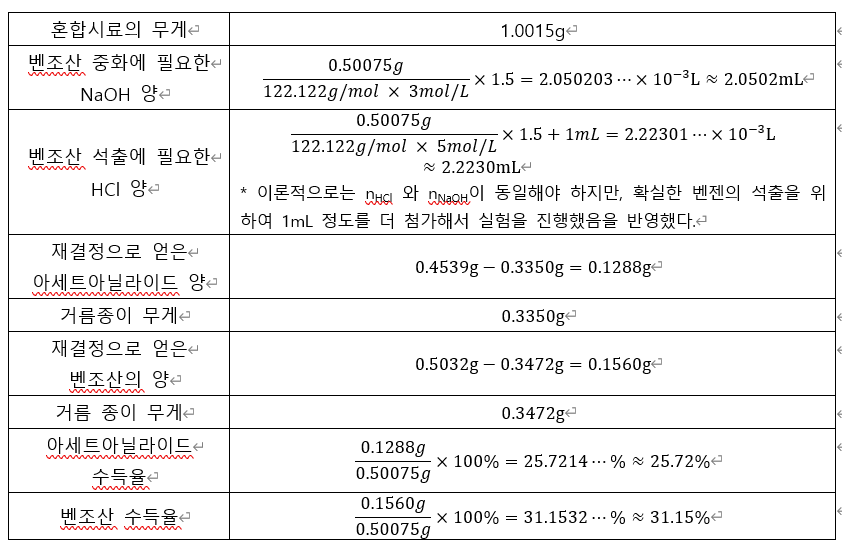
1. Data Sheet
* 계산 시 혼합 시료에서 벤조산과 아세트아닐라이드의 무게가 각각 50%라는 조건 하에서 값을 구했다.
Ⅶ. Discussion
1. 실험 진행 이유 및 현상 관찰
혼합물을 분리할 수 있는 특성에는 여러가지가 있다. 다만 혼합물을 구성하는 물질이 비슷한 특성을 갖고 있다면 한 가지 요인만 이용하면 물질을 분리해내기가 쉽지 않다. 이번 실험에서 분리하려는 Acetanilide(이하, 아세트아닐라이드)와 Benzonic acid(이하, 벤조산)도 온도에 따른 물에 대한 용해도가 비슷하기에 단순한 물에 대한 용해도의 차이만으로는 물질을 분리할 수 없다. 한편, 벤조산이 카복시기(−COOH)를 포함한 약산이며, 염기와 쉽게 반응한다. 이 특성을 이용해서 물에 대한 용해도와 pH에 의한 용해도의 특성을 이용해서 혼합된 물질들을 분리한다. 혼합물의 구성물질이 물에 대한 용해도가 비슷하기 때문에 우선 벤조산과 강염기 Sodium Hydroxide(이하, 수산화나트륨)의 반응으로 먼저 벤조산을 용해한다. 벤조산은 약산이기에 중화 반응을 일으키더라도 염의 가수분해로 인해 용해가 되지 않은 상태로 돌아갈 수 있다. 이를 고려하여 벤조산을 완전히 중화하기 위해 예상된 수산화나트륨의 양보다 1.5배 많은 2mL 정도를 넣으면 될 것으로 확인했으나, 벤조산의 포함 비율이 혼합시료의 50%가 아닐 수 있다는 가능성을 고려하여 실제 실험에서는 수산화나트륨을 3mL 정도 사용했다. 혼합 시료와 수산화나트륨을 포함한 수용액에는 이온 형태로 용해된 벤조산 이온과, 아직 충분히 용해되지 못한 아세트아닐라이드가 포함되어 있을 것이다. 최대한 많은 아세트아닐라이드를 얻기 위해서 일반적인 고체는 계의 온도가 높아짐에 따라 용해도가 증가하는 성질을 이용했다. 아세트아닐라이드는 95℃에서 물 1L에 대해 50g이 녹을 수 있으며, 실제 실험에서 사용된 물의 양은 약 18mL로 이에 대해 아세트아닐라이드는 같은 온도에서 0.9g이 녹을 수 있다. 최대한 순수하고 많은 양의 아세트아닐라이드를 습득하기 위하여 육안으로 결정을 찾을 수 없더라도 물이 거의 끓을 때까지 기다려 시료 속의 아세트아닐라이드가 충분히 녹을 수 있도록 했다. 아세트아닐라이드를 다시 결정 상태로 얻고자 용액을 식혔다. 원래는 상온에서 식혀 결정이 최대한 크고 잘 형성될 수 있도록 해야 하는데 시간상의 문제로 얼음을 이용해서 용액을 최대한 빠른 시간에 충분히 식혔다. 거름종이만 이용하는 것 보다 빠르게 용액에서 결정 형태의 고체만 얻고자 감압 장치를 이용해서 용액을 걸렀다. 다만, 수용액의 부피에 비해 다소 큰 비커를 사용했기에 얼음에서 이를 식히는 과정에서 열교환이 쉽게 발생해서 물이 거의 남지 않았다. 그래서 비커 내부에 붙어있는 결정을 떼어내고자 물로 섞는 과정을 추가했으며, 이때 너무 물을 세게 부어 결정이 비커 밖으로 나가지 않도록 물을 넣을 때 눈금실린더를 사용했다. 감압 후 결정 표면에 붙어있을 수 있는 벤조산이나 불순물을 제거하기 위해, 용액을 빠른 시간 내에 냉각한 것을 감안하여 눈금 실린더로 결정을 천천히 찬물로 세척했다. 한편, 걸러지고 나온 용액에 남아있는 벤조산을 다시 얻어내기 위하여 이온 형태로 존재하는 벤조산 이온을 다시 고체 형태로 바꿀 필요가 있었다. 이를 위하여 아세트아닐라이드만 석출하기 위하여 넣어줬던 수산화나트륨의 몰수만큼 hydrochloric acid(이하, 염산)을 넣어주었다. 이때 이론적으로는 염산 1.2mL 정도가 필요하지만 확실하게 벤조산을 석출하고자, 앞서 수산화나트륨을 3mL가량 넣었다는 것을 바탕으로 염산 3.5mL를 넣었다. pH의 변화로 더 이상 이온 현태로 존재하지 못하게 된 벤조산 이온이 다시 고체로 변하면서 용액이 뿌옇게 흐려지는 것을 확인할 수 있었다. 앞서 아세트아닐라이드를 석출했던 것처럼 용액을 가열하여 남아있던 고체를 모두 녹이고 다시 식혀 거름을 통해 벤조산 결정을 수득했다. 각각의 과정으로 얻은 결정은 아직 수분을 모두 포함하고 있는 상태이기에 질량을 정확히 측정할 수 없었다. 그래서 하루동안 오븐에서 건조를 했고 실험 다음날 측정한 질량에서 각 결정을 받치기 위해 사용했던 거름종이의 질량을 제외하여 수득한 결정 각각의 질량을 얻을 수 있었다.
2. 실험 결과 분석 및 오차 발생 이유
실험을 통하여 얻은 아세트아닐라이드와 벤조산의 실제 수득 질량과 수득률을 정리해보자.
|
|
실제 수득 질량 (g) |
수득율 (%) |
|
아세트아닐라이드 |
0.1288 |
25.72 |
|
벤조산 |
0.1560 |
31.15 |
|
합계 (이상적 상황) |
1.0015 |
200 |
|
합계 (실제 실험값) |
0.2848 |
56.87 |
* 여기서 말하는 이상적 상황은 전 실험 과정에서 불순물이 섞이지 않고 손실되거나 추가되는 질량이 없이 완벽하게 실험이 진행된 상황을 뜻한다.
우선 수득율에 대해서는 크게 논의하지 않겠다. 왜냐하면 재결정을 위해 사용했던 시료의 조성을 정확하게 모르기 때문에 정확한 수득율을 구할 수 없기 때문이다. 수득율에 대한 오차에 대해 논의하려고 하면 혼합 시료를 직접 만드는 과정도 실험 과정에 포함되어 있어야 할 것이다. 본론으로 돌아와, 수득율의 수치보다는 1) 아세트아닐라이드와 벤조산의 실제 수득 질량의 합이 0.2848g으로 실제 분석을 위해 사용했던 혼합시료의 질량 1.0015g보다 현저히 낮다는 점, 그리고 2) 수득한 아세트아닐라이드 혹은 벤조산이 얼마나 순수할 수 있는가에 대해 주목하여 실험 결과를 살펴봐야 한다.
1) 실제 수득 질량이 처음에 측정한 혼합 시료의 질량보다 현저히 낮음
수득 후 측정한 시료들의 질량의 총 합이 초기에 측정된 혼합물의 질량보다 매우 낮다는 것은 무게를 측정할 때 발생될 수 있는 오차보다는 또 다른 요인이 있기에 가능할 것이다. 이에 대해 살펴보자. 첫 번째로 용액들을 계속 옮기는 과정에서 시료들의 손실이 발생할 수 있다. 이번 실험에서는 시료를 끓이고 감압하는 과정에서 계속 용액을 옮겨야 한다. 그 과정에서 최대한 남은 방울까지 다 옮긴다 하더라도 실험자의 숙련도 미숙으로 인하여 눈치채지 못하고 미처 옮기지 못하고 비커, 감압 플라스크 뷰흐너 깔때기, stirring bar 등에 시료가 묻어있을 수 있다. 이는 시료가 손실되는 것을 의미하므로 후에 측정한 질량이 감소할 수 있는 원인에 해당한다. 또한 재결정 과정의 문제로 시료가 정확하게 수득되지 않았을 수 있다. 용해된 물질이 결정화되려면 외부의 충격 없이 최대한 천천히 식혀 충분한 크기가 되도록 해야 한다. 하지만, 보다 용이한 실험을 위해서 얼음을 이용해서 용액을 냉각했으며, 이는 급작스러운 온도 변화를 야기했다. 이는 곧 용해도가 급격하게 변해 녹아 있던 시료들이 충분히 얽히지 못하고 석출되어 버릴 수 있는 환경을 제공하는 것으 뜻한다. 또한 각 조의 용액을 개개인이 냉각한 것이 아니라 앞의 얼음통에 같이 넣고 냉각을 진행했다. 이는 다른 조원들이 비커를 넣고 빼는 과정에서 그 통에 있던 비커들에도 충격이 전해질 수 있음을 뜻하고, 이는 결정이 온전히 형성될 수 없는 가능성을 제시한다. 뿐만 아니라 최대한 많은 시료를 빼낼 수 있는 용액의 온도를 알아야 하는데 실험 수업 시 온도계가 제공되지 않아 적당한 시간이 흐른 것만으로 용액이 충분히 냉각되었다고 판단해서 감압 거름을 진행했기에 결정이 충분히 형성되지 않았을 수 있다. (다만, 만약 온도계가 제공된다 하더라도, 실험 결과에 영향을 주지 않을 정도로 오차가 나지 않게 하려면 용액을 매우 차갑s게 만들어야 한다. 그러나 실험실 환경에서의 계와 주변사이의 열교환만으로는 충분히 냉각하는 것이 사실상 불가능하기 때문에 온도계가 제공되었더라도 용해된 아세트아닐라이드를 모두 결정으로 석출시키는 것은 힘들었을 것이다.) 결정이 충분히 석출되지 않았다는 것은 용해된 시료가 모두 결정이 되지 않았음을 뜻하기도 하지만, 외부 영향 변화에 영향을 받지 않는 정도로 결정이 크게 형성되지 않았음을 뜻하기도 한다. 크기가 작은 결정은 후에 결정을 세척하는 과정에서 영향을 받을 수 있다. 용질의 크기가 작을수록 용질 사이의 상호작용이 감소한다. 또한 같은 양의 용질이 있을 때, 용질 입자의 크기가 작을수록 용매와의 접촉면적이 증가한다. 뿐만 아니라 용질의 크기가 작을수록 용액에 더 잘 분산될 수 있으므로 엔트로피도 증가한다. 이 요인들은 곧 용질의 입자가 작을수록 더 쉽게 용해됨을 뜻한다. 그렇기에 완전하게 결정을 얻은 상태보다 세척을 했을 때 더 쉽게 용해될 수 있는 가능성이 존재했고 이는 곧 수득 용질의 감소로 이어졌다고 판단되었다. 주된 요인은 아니지만, 오븐을 다같이 이용하며, 오븐 내의 시료 확인 시 거름종이를 받치는데 사용했던 시약종이에도 결정 가루들이 떨어져 있었던 것으로 보아 건조과정에서도 질량의 변화가 있을 수 있다고 판단할 수 있었다. 또한 실험을 한 번만 진행했기에 실험자의 미숙으로 여러 번 진행해서 얻은 평균값에서 거리가 먼 결과를 얻었을 수도 있다. 혼합 시료 추출 시 시료의 조성을 완벽하게 동일하게 설정할 수는 없기에 반복된 실험을 통해 유의미한 평균값과 이번 실험에 대해 불확정도를 구하면 보다 이 실험 결과값의 신뢰 정도도 고려할 수 있을 것이다.
2) 수득한 물질들이 얼마나 순수할 수 있는가?
이번 실험의 목적은 혼합물을 재결정을 통해서 각 구성 물질로 ‘분리’하는 것이다. 분리는 혼합물에서 최대한 순수하게 물질들을 구별하는 것이 목표이므로, 실험 결과로 얻은 물질들이 얼마나 순수한지도 고려해야 한다. 직접 실험을 통해서 순수한 정도를 얻지는 않았다. 만약 이를 얻고자 한다면 녹는점 측정기를 사용하여 순물질의 녹는점과 얻은 시료의 녹는점 사이의 차이를 비교해보면 알 수 있다. 또한 순수한 시료와 실험을 통해 얻어낸 시료의 가열곡선을 얻어 비교해보면 얻어낸 결정이 순수한지 알 수 있다. 시료가 고체에서 액체로 될 때 가열 곡선이 x축과 거의 평행하지 않고 우상향하는 모습을 보이면 그 시료는 순수하지 않음을 확실히 알 수 있다. 그리고 만약 불순물의 끓는점이 시료보다 낮다면 인근에 비해 기울기가 작은 부분이 2번 이상 나타날 것이다.
진행한 실험 결과를 바탕으로 시료들의 오염 가능성을 살펴보자. 여기서 말하고자 하는 ‘오염’은 실험 과정 중 계의 외부에서 유입된 불순물에 의한 오염이 아닌, 분리를 정확하게 해내지 못해 시료가 혼합된 상태임을 뜻한다. 즉, 분리를 정확하게 해내지 못한 정도에 대해서만 이야기해보도록 하자. 우선 첫 번째 재결정 과정에서 얻은 아세트아닐라이드는 오염될 가능성이 적다. 왜냐하면 산과 염기에 의한 반응은 반응 속도가 빠른 반응이기에 대부분의 벤조산이 용해된 상태이기 때문이다. 그러나 실험에서 재결정화된 아세트아닐라이드의 질량이 매우 작았기에 벤조산의 오염을 의심해볼 수 있다. 용해과정과 재결정과정에서 문제가 생겼다면 미처 석출되지 못한 용해된 아세트아닐라이드가 존재할 수 있다. 또한 아세트아닐라이드와 벤조산의 물에 대한 용해도는 거의 유사하기에 벤조산의 석출을 위해 물을 가열하면 아세트아닐라이드도 같이 용해될 수 있다. 이를 종합하면, 벤조산을 재결정하는 과정에서 순수한 벤조산만 결정으로 석출되는 것이 아니라 아세트아닐라이드도 같이 석출될 가능성이 존재한다. 두 물질의 밀도는 비슷하며, 육안으로 결정의 형태를 통해 둘을 구별하는 것이 힘들다. 아세트아닐라이드의 수득 결과를 통해 혼합 시료속의 모든 아세트아닐라이드를 석출했다고 판단하기 힘드므로, 벤조산으로 석출되었다고 판단되는 질량 0.1560g은 오염으로 인하여 신뢰성이 약간 떨어진다고 볼 수 있다.
3. 재결정을 통해 얻은 물질의 종류를 구분하는 방법
녹는점 측정기를 사용하면 물질의 순도도 결정해볼 수 있겠지만, 그 물질이 어떤 물질인지를 구분해줄 수도 있다. 만약 재결정을 통해서 두 물질을 완전히 분리하는데 성공했다고 했을 때 어떤 방법을 통해서 두 물질을 구분할 수 있을지 살펴보도록 하자.
1) 크로마토그래피를 이용하면 분류한 두 물질의 종류를 구분할 수 있을 것이다. 다만 수득한 형태가 고체이기에 크로마토그래피를 진행하기에는 어려움이 있다. 그래서 우선 두 물질을 충분히 가열해서 액체 상태로 만드는 것부터 시작해야한다. 하지만, 두 고체 모두 무색이므로 단순히 크로마토그래피를 적용하는 것은 도움이 되지 않는다. 즉, 추가적인 설계가 필요하다는 것을 의미한다. 같은 조건으로 형성된 칼럼에 대해 같은 양의 시료를 넣는다. 그리고 칼럼 아래에는 페놀프탈레인 지시약을 첨가한 강염기성의 용액을 둔다. 만약 칼럼에서 액체 시료가 떨어졌는데 용액에 아무런 변화가 없다면, 이는 아세트아닐라이드를 뜻할 것이다. 하지만 만약 그 액체 시료가 벤조산이라면 중하반응에 의하여 용액의 pH가 감소할 것이며, 특정 시점을 기준으로 용액이 투명해질 것이다. 이 특성을 이용한다면 두 시료가 각각 분리되어 있어도, 두 액체 상태의 시료가 혼합되어 있어도 물질의 특성을 이용해서 시각적으로 물질을 구별할 수 있다. 만약 두 시료를 기체 형태로 바꾸고, 이들을 잘 수득할 수 있다면 기체 크로마토그래피를 이용한 결과를 해석하여 이미 존재하는 데이터와 비교하면 자신이 얻어낸 물질이 무엇인지 구분할 수 있을 것이다.
2) 분광 화학법을 이용하면 두 물질을 구분할 수 있을 것이다. 어떤 물질을 전자기 스펙트럼을 이용해서 분석하면 물질마다 고유한 값을 얻을 수 있다. 어떤 영역의 빛을 사용하는지에 따라서 사용하는 기계의 종류도 다양하며, 분석 방법도 다양하다. 순수한 벤조산과 아세트아닐라이드를 적외선 영역(IR)에서 빛을 쐬어 결과를 살펴보면 확연한 차이점을 얻을 수 있다. 분석기로 얻은 결과와 인터넷 사이트 등에서 얻을 수 있는 자료를 비교해보면 실제로 자신이 분석한 물질이 어떤 것인지 알 수 있다. 실제로 IR 분석법을 이용하면 아세트아닐라이드와 벤조산의 분광 분석 결과를 다음과 같이 확인할 수 있다.

3) 고체상의 등압 몰 비열 비교를 해도 물질을 구분할 수 있다. 이상 기체에 대하여 일정한 압력에서 같은 온도에서 같은 양의 온도를 변화시켰을 때 들어간 열량을 이용하여 기체들의 종류를 구분할 수 있었다. 이를 확장하여 어떤 고체 상에 있는 두 물질을 같은 온도에서 같은 온도 변화량만큼 변화를 두면 열량이 변할 것이다. 이 값을 이용해서 고체 상태의 등적 몰비열을 계산하면 두 물질을 비교할 수 있을 것이다. 실제로 298.15K에서 아세트아닐라이드의 Cp,solid=179.3kJ/mol∙K이며, 벤조산의 경우 Cp,solid=146.65kJ/mol∙K이다.
Ⅷ. References
1. 대한화학회, 표준 일반화학실험 제 7판, 천문각, 2011, pp. 35~41
2. John R.Rumble, CRC Handbook of Chemistry and Physics 85th edition, pp. 3-4, 3-42, 4-60, 4-85
3. Brown 외 5인 및 화학교재연구회 옮김, 일반화학 제 14판, Pearson 및 자유아카데미, 2019, pp. 568 ~ 594
4. 박기라 및 윤희숙, 액체 혼합물의 끓음에 대한 예비 화학교사의 이해, 강원대학교 과학교육부, 2015, pp. 455 ~ 464
5. 박종윤, 두가지 염이 동시에 물에 녹을 때의 용해도, 이화여자대학교 과학교육과, 2009, pp. 453 ~ 464
6. 오도석, CHROMATOGRAPHY 1st reviced edition, 학술편수관, 2012. pp. 13~145 282~287
7. Haiilday 외 2인, Fundamentals of Physics 10th edition, Wiley, 2013, pp. 566~567
'자료.zip > 일반화학실험' 카테고리의 다른 글
| 평형 상수와 용해도곱 결정 실험 결과 해석 (1) | 2021.12.04 |
|---|---|
| 산화/환원 적정 : 과망간산법 (0) | 2021.11.26 |
| 크로마토그래피(Chromatography) (2) | 2021.02.09 |
| 나일론 합성 (5) | 2021.01.30 |
| 엔탈피 측정 (0) | 2021.01.28 |