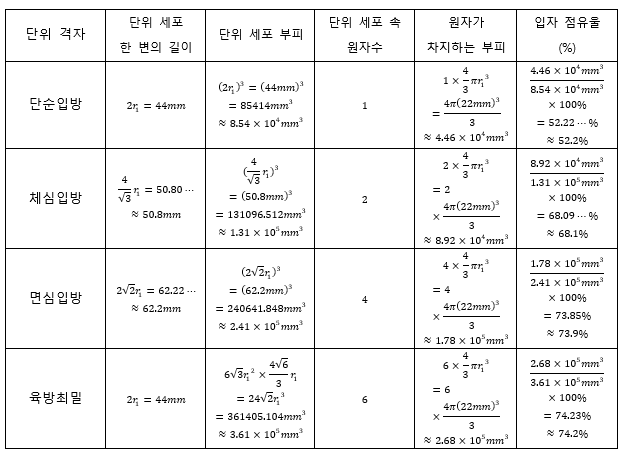
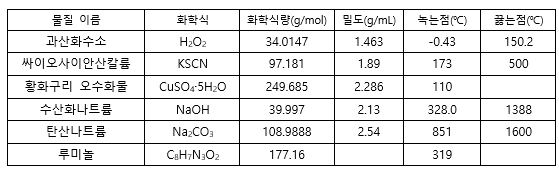
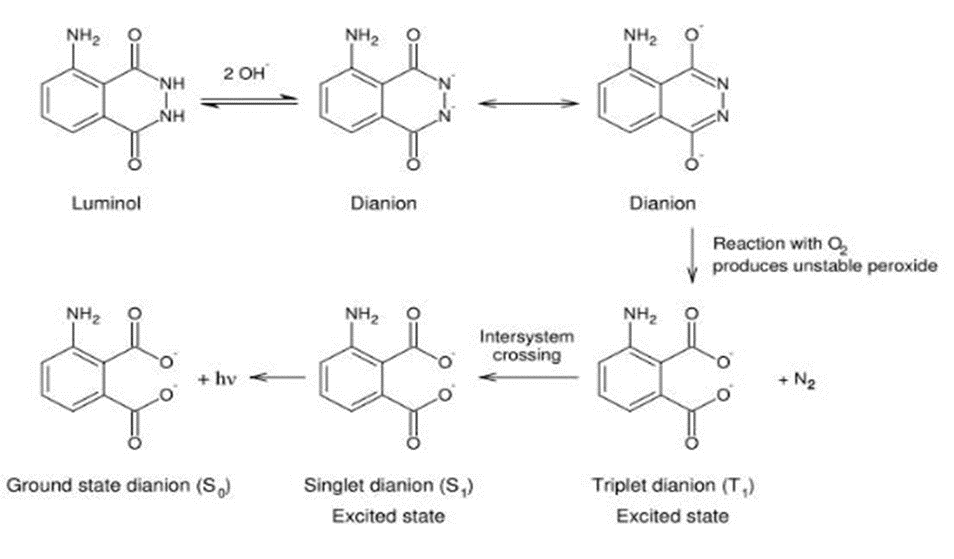
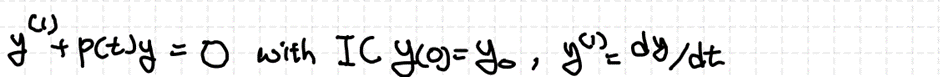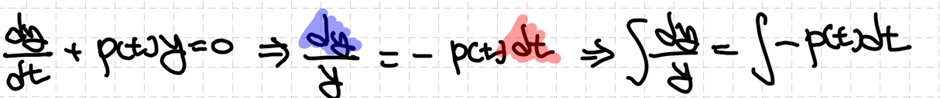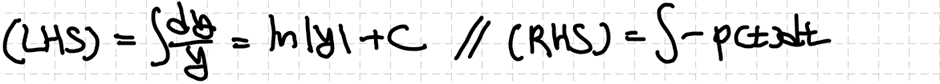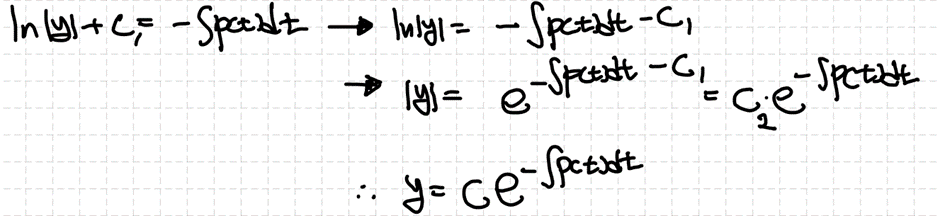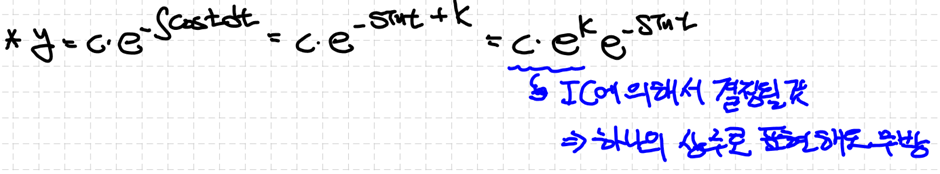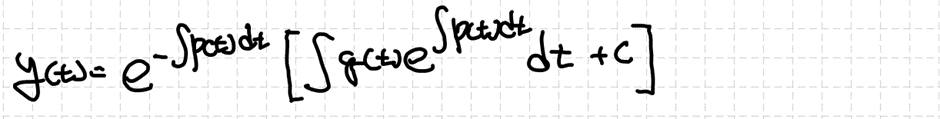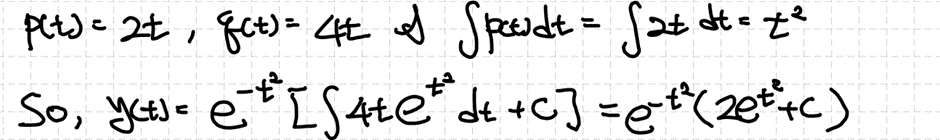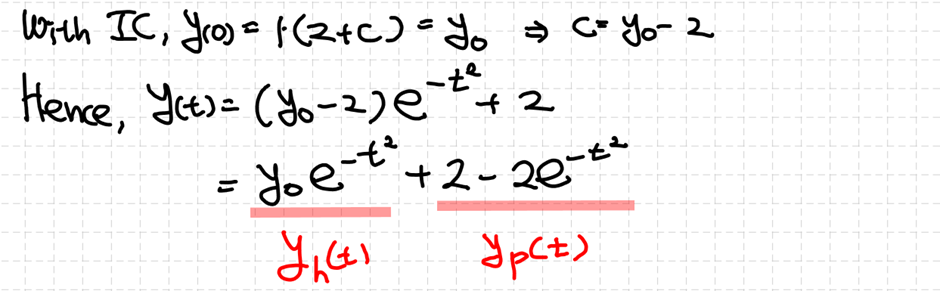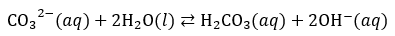Contents
1. 2차 선형 상미분방정식의 형태 (the Formulation of 2nd order Linear ODE)
2. 2차 선형 미분방정식의 해의 존재성(Existence)과 유일성(Uniqueness)
3. 2차 상미분방정식의 해의 형태
4. 선형조합과 선형독립 (Linear Combination and Linear Independence)
2차 상미분방정식은 매우 중요합니다. 고전역학에서 속도-가속도 관계를 동시에 표현할 때 2차 선형 상미분방정식 형태를 얻을 수 있습니다. 그리고 많은 편미분방정식을 풀이하기 위해서 2차 상미분방정식을 풀 수 있어야 합니다. 그래서 2차 상미분방정식에 대해서는 조금 자세하게 다룰 필요가 있습니다. 그 중에서도 2차 선형 상미분방정식에 대한 개념을 전반적으로 살펴보도록 하겠습니다.
1. 2차 선형 상미분방정식의 형태 (the Formulation of 2nd order Linear ODE)
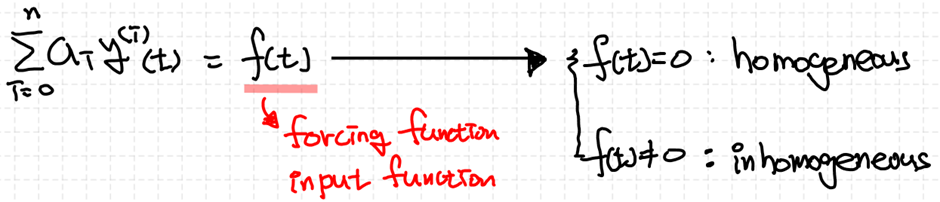
2차 선형 상미분방정식의 형태를 상미분방정식의 일반형태로부터 이끌어낼 수 있습니다.

1차 ODE처럼 2차 ODE도 forcing function r(t)의 유무에 따라 제차인지 비제차인지 구분됩니다.

2. 2차 선형 미분방정식의 해의 존재성(Existence)과 유일성(Uniqueness)
주어진 미분방정식을 풀이하는 것은 중요합니다. 강의를 들을 때 나오거나 전공서적에 나와있는 문제들은 모두 답이 나오도록 잘 짜여 있습니다. 만약 모델링을 거쳐 미분방정식을 얻어냈을 때, 해당 미분방정식의 해가 존재하는지 그리고 그 해를 유일하게 결정할 수 있는지를 알 필요가 있습니다. 존재성과 유일성은 증명이 가능한 성질이나, 우선 어떤 조건에서 해가 존재하고 또 유일할 수 있는지에 대해 살펴보고자 합니다.
1) 해의 존재성 (Existence)
2차 ODE에서 계수로 취해진 함수 (p(t),q(t),r(t))가 미분방정식이 정의된 구간 I에서 연속일 때 해가 존재한다고 생각할 수 있습니다.

2) 해의 유일성 (Uniqueness)
2차 ODE에서 초기조건 IC가 다음과 같이 제시되어 있다면 해당 미분방정식은 1개의 유일한 해 (적합해)를 갖습니다.

즉 초기 조건이 2개는 제시되어야 해가 유일하게 결정됩니다. 이는 미분을 하면 정보량이 줄어들고, 반대로 적분을 하면 정보량이 증가하기 때문입니다.
3. 2차 상미분방정식의 해의 형태
1) 제차 상미분방정식의 해의 형태
제차 2차 선형 상미분방정식의 경우 자명한 해를 두어 ODE의 해를 구할 수 있습니다. 자세한 방법은 추후에 살펴보도록 합시다. 그 결과 얻어낸 두 해는 서로 일차독립(linearly independent)이여야 하고, 제차 미분방정식에서의 해는 그 둘의 선형조합(linear combination)으로 결정합니다.

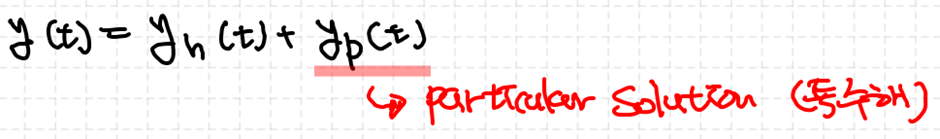
2) 비제차 상미분방정식의 해의 형태
비제차 2차 선형 상미분방정식도 해를 얻을 수 있습니다.

이때 yh는 r(t)=0으로 두고 해를 구하는 것입니다. 그리고 yp는 차수비교법, 역연산자법, 그리고 매개변수 변환법을 이용해서 구할 수 있습니다. 마찬가지로 추후에 살펴보도록 하겠습니다.
4. 선형조합과 선형독립 (Linear Combination and Linear Independence)
2차 상미분방정식부터는 해의 기저들을 구하고, 이를 더하는 방식으로 해를 결정합니다. 선형조합, 선형독립, 선형종속에 대해 알아야 합니다.
1) 선형조합 (Linear Combination, Superposition)
선형조합은 기저들을 더하는 것을 얻을 수 있고 수학적으로는 아래처럼 표현합니다.
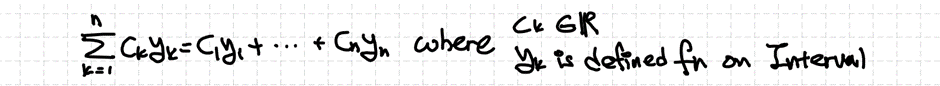
2) 선형독립과 선형종속 (Linear Independence and Linear Dependence)
선형독립과 선형종속은 선형조합에서 사용된 기저해(yk)의 일차독립성을 판단하는 것입니다. 만약 선형조합이 0일 때 기저해의 계수들이 어떠한 형태로 나타나는 지에 따라 선형독립인지 아닌지 결정됩니다. 수학적으로는 다음과 같이 표현할 수 있습니다.

이해가 안 될 수 있으니 예시를 통해 설명해드리겠습니다.
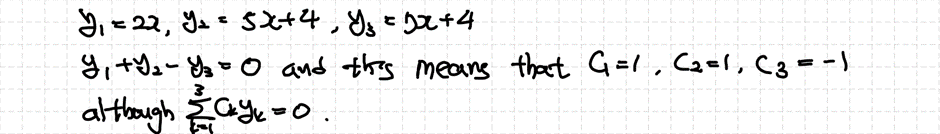
어떠한 3개의 기저해가 있을 때 이를 적당히 더해서 0을 만들 수 있습니다. 즉, 선형조합이 0이 될 때 모든 계수 ck가 0이 되지 않는 조합이 존재하므로 세 함수는 선형종속임을 알 수 있습니다.
선형독립성을 분석해야 하는 함수의 개수가 적으면 적당한 조합으로 그 독립성을 판단하기 쉽습니다. 하지만 해의 형태가 단순한 다항식이 아니거나, 분석해야 하는 함수들의 해수가 너무 많을 때에는 독립성을 판단할 때 실수하기 쉽습니다. 그래서 다른 수학적 도구를 이용해서 선형독립을 판단합니다.
3) 론스키안(Wronskian)
어떠한 구간 I에 대해 정의된 (n−1)번 미분가능한 해 y1,y2,⋯,yn에 대해 다음과 같은 수학적 표기를 할 수 있습니다.
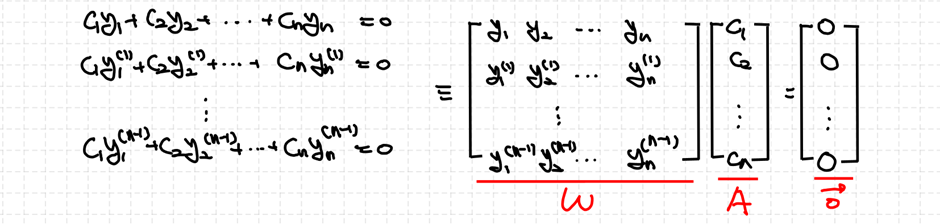
이때 우리가 정의한 행렬 W를 론스키안(Wronskian)이라고 합니다.
그리고 행렬 A에 따라서 선형독립과 선형종속이 결정됩니다.

즉, 주어진 해들이 선형종속일 때 론스키안의 Determinant가 0인 것을 결정할 수 있으며, 우리는 명제의 논리를 이용해서 다음의 결과를 얻을 수 있습니다.

즉, det(W)이 0이 아니라면 우리는 얻어낸 해를 바로 사용할 수 있음을 의미합니다.
'전공 개념.zip > 상미분방정식 (ODE's)' 카테고리의 다른 글
| 5. 라그랑쥐의 차수축소법 (0) | 2022.03.13 |
|---|---|
| 부록 1 미분방정식과 조건설정 (0) | 2022.03.11 |
| 3. 1차 선형 상미분방정식 (2) 라플라스 변환의 적용 (1) | 2022.03.10 |
| 2. 1차 선형 미분방정식의 풀이 (1) (0) | 2022.03.09 |
| 1. 상미분방정식의 형태 및 문제풀이 접근방법 (0) | 2022.03.09 |